| > | restart:#"m09_pp5 |
Un motor cohete de propulsante lĂquido usa keroseno (supĂłngase dodeceno) y N2O4. Suponiendo reacciĂłn estequiomĂ©trica completa, se pide:
a) Masa molar y relación de capacidades térmicas de los gases producto.
b) EnergĂa liberada por unidad de masa de keroseno, y comparaciĂłn con el PCI de la combustiĂłn de keroseno en aire.
c) Temperatura de combustión adiabática.
d) Velocidad de salida de los gases para una presión de cámara de 7 MPa y salida adaptada a 100 kPa.
Datos:
| > | read`../therm_eq.m`:read`../therm_chem.m`:with(therm_chem);with(therm_proc):#Global Elem,Comp,C_,MfComp,cpComp,eqNX,eqBC,eqBH,eqBO,eqBN,eqBS,delta_
|
| > | su1:="C12H24":su2:="N2O4":su3:="N2":su4:="CO2":su5:="O2":su6:="H2O":dat:=[pc=7e6*Pa_]: |
Eqs. const.:
| > | dat:=op(dat),op(subs(g=g0,[Const])),SI2,SI1:N2dat:=get_gas_data("N2"):CO2dat:=get_gas_data("CO2"):O2dat:=get_gas_data("O2"):H2Odat:=get_gas_data(su6):eqF:=Mf(su1);eqNTO:=Mf(su2); |
a) Masa molar y relación de capacidades térmicas de los gases producto.
| > | eq0:=eq_fit(C12H24+a*N2O4=b*CO2+d*H2O+e*N2);eq7_2;Mm:=x[CO2]*M[CO2]+x[H2O]*M[H2O]+x[N2]*M[N2];eq0_:=eqMIX(a*C12H24+b*N2O4=[3,4,6]);sol_:=evalf(solve({eqBC,eqBH,eqBO,eqBN,eqNX},{a,b,x[CO2],x[H2O],x[N2]}));Mm_:=subs(sol_,M[CO2]=M1,M[H2O]=M2,M[N2]=M3,M1=M,CO2dat,M2=M,H2Odat,M3=M,N2dat,Mm);eqcpmol:=lhs(sum(delta_[i]*x[Comp[i]]*cpComp[i],i=1..C_))=subs(sol_,rhs(sum(delta_[i]*x[Comp[i]]*cpComp[i],i=1..C_))); |
![M = Sum(`*`(x[i], `*`(M[i])), i = 1 .. C)](images/p471_6.gif) |
|
| (1) |
i.e. la masa molar de la mezcla es 0,030 kg/mol, y su capacidad térmica media a alta temperatura (i.e. con salida a unos 2000..2500 K) cp=46 J/(mol·K).
b) EnergĂa liberada por unidad de masa de keroseno, y comparaciĂłn con el PCI de la combustiĂłn de keroseno en aire.
| > | eq15_5_;eqPCs;PCI_NTO:=PCI(eq0);PCIm_NTO:=%/rhs(eqF);eq1:=eq_fit(C12H24+a*O2=b*CO2+d*H2O+e*N2);PCI_O2:=PCI(eq1);PCIm_O2:=%/rhs(eqF); |
![PCS = `+`(`-`(`/`(`*`(Sum(`*`(x[i], `*`(h[std, i])), i = 1 .. C)), `*`(a))))](images/p471_12.gif) |
|
| (2) |
Se liberan 44,5 MJ/kg cuando se usa NTO, y 44,0 MJ/kg cuando se usa O2 (da igual si está disuelto con N2). La pequeña diferencia es debida a la entalpĂa de formaciĂłn del N2O4. Pero la enorme ventaja del NTO es que es fácilmente licuable (a T ambiente, no a T criogĂ©nica), y además genera más gases.
c) Temperatura de combustión adiabática.
| > | subs(sol_,eq0_);eq15_7_2;Ta_:=subs(PCI_=PCI_NTO,sol_,cpComp,dat,rhs(eqTa));'Ta_'=TKC(%); |
![Ta = `+`(T25, `/`(`*`(a, `*`(PCI)), `*`(Sum(`*`(x[Com[i]], `*`(c[p, i])), i = 1 .. CP))))](images/p471_20.gif) |
|
| (3) |
La temperatura de combustiĂłn adiabática para la proporciĂłn RP1/NTO estequiomĂ©trica serĂa de 5200 K si no hubiera disociaciĂłn ni ionizaciĂłn, que a esas temperaturas es importante y no hemos contabilizado (y deberĂamos haber usado valores mayores para los cp a tan altas temperatura); i.e. en realidad será bastante menor.
NOTA. En la práctica, los reactivos no se combinan estequiomĂ©tricamente (1 a 9 molar, i.e. 1 a 4,93 en masa), sino con exceso de combusticle (1 a 4 en masa) para generar todavĂa más gases (CO, H2, y OH, principalmente), y tan solo se alcanzan Ta=3500 K. Esta mezcla RP1/NTO es muy econĂłmica y se usĂł hacia 1980 en la primera etapa de algunos lanzadores, aunque actualmente se prefiere la combinaciĂłn RP1/LOX..
d) Velocidad de salida de los gases para una presión de cámara de 7 MPa y salida adaptada a 100 kPa.
En una tobera ideal se conservan las magnitudes de remanso. Como a la entrada la velocidad es pequeña, tendremos:
| > | eqBE:=Tt=T+v^2/(2*c[p]);eqBS:=Tt/T=(pt/p)^((gamma-1)/gamma);M_:=Mm_;cp_:=rhs(eqcpmol);gamma_:=subs(dat,cp_/(cp_-R[u]));Tt_pt_p:=subs(Tt=Ta_,pt=pc,p=p0,dat,[Tt,pt,p]);T2:=Ta*(p2/pc)^((gamma-1)/gamma);p2=p0;T2_:=subs(Ta=Ta_,p2=p0,c[p]=cp_*M_,gamma=gamma_,dat,T2);v:=sqrt((Ta-T)*2*c[p]);v_:=evalf(subs(Ta=Ta_,T=T2_,c[p]=cp_/Mm_,dat,SI2,%));Tt_pt_p:=subs(Tt=Ta_,pt=pc,p=0,dat,[Tt,pt,p]);'T2'=0;v_:=evalf(subs(Ta=Ta_,T=0,c[p]=cp_/Mm_,dat,SI2,v)); |
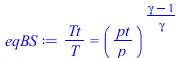 |
|
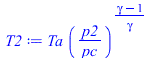 |
|
| (4) |
i.e. con el valor antes calculado para la temperatura en la cámara, Ta=5226 K, en la expansiĂłn desde 7 MPa hasta 100 kPa se acelerarĂan los gases hasta 2,9 km/s.
En el vacĂo se acelerarĂan hasta 4 km/s (siempre con la suposiciĂłn de tobera adaptada). Pero, como se ha dicho antes, los valores reales serán menores.
| > |