| > | restart:#"m09_p07" |
En un dispositivo cilindro émbolo que mantiene la presión constante se tiene inicialmente 1 mol de O2 a 25 °C y 100 kPa. Considérese disponible una fuente infinita de carbono (p.e. las paredes del cilindro) y estúdiese el equilibrio de la mezcla gaseosa CO2/CO/O2 en función de la temperatura. En particular, se pide:
a)•Determinar la composición de equilibrio, pensando que sólo se genera CO2.
b)•Determinar la composición de equilibrio pensando que aparece CO2 y CO.
Datos:
| > | read`../therm_chem.m`:with(therm_chem):with(therm_proc): |
| > | su:="H2O":dat:=[n0[2]=1]; |
Eqs. const.:
| > | dat:=op(dat),op(subs(g=g0,[Const])),SI2,SI1: |
Ecuaciones de equilibrio químico posibles:
| > | eq1:=C+O2=CO2;eqEQ1:=subs(dat,evalf(subs(p=p0,dat,eqEQ(%))));use RealDomain in ln(lhs(%))=ln(op(1,op(2,%)))+ln(op(2,op(2,%))) end use;eqEQ1_1000K:=lhs(eqEQ1)=evalf(subs(T=1000*K_,rhs(eqEQ1)));eqEQ1_3000K:=lhs(eqEQ1)=evalf(subs(T=3000*K_,rhs(eqEQ1))); |
![`/`(`*`(x[CO2]), `*`(x[O2])) = `+`(`*`(1.414730984, `*`(exp(`+`(`/`(`*`(47332.21074, `*`(K_)), `*`(T)))))))](images/p071_3.gif) |
| > | eq2:=C+(1/2)*O2=CO;eqEQ2:=subs(dat,evalf(subs(p=p0,dat,eqEQ(%))));use RealDomain in ln(lhs(%))=ln(op(1,op(2,%)))+ln(op(2,op(2,%))) end use;eqEQ2_1000K:=lhs(eqEQ2)=evalf(subs(T=1000*K_,rhs(eqEQ2)));qEQ2_3000K:=lhs(eqEQ2)=evalf(subs(T=3000*K_,rhs(eqEQ2))); |
![`/`(`*`(x[CO]), `*`(`^`(x[O2], `/`(1, 2)))) = `+`(`*`(46119.19639, `*`(exp(`+`(`/`(`*`(13294.44311, `*`(K_)), `*`(T)))))))](images/p071_8.gif) |
![ln(`/`(`*`(x[CO]), `*`(`^`(x[O2], `/`(1, 2))))) = `+`(10.73898455, `/`(`*`(13294.44311, `*`(K_)), `*`(T)))](images/p071_9.gif) |
![`/`(`*`(x[CO]), `*`(`^`(x[O2], `/`(1, 2)))) = 0.2738955737e11](images/p071_10.gif) |
![`/`(`*`(x[CO]), `*`(`^`(x[O2], `/`(1, 2)))) = 3876586.618](images/p071_11.gif) |
| > | eq3:=C+CO2=2*CO;eqEQ3:=subs(dat,evalf(subs(p=p0,dat,eqEQ(%))));use RealDomain in ln(lhs(%))=ln(op(1,op(2,%)))+ln(op(2,op(2,%))) end use;eqEQ3_1000K:=lhs(eqEQ3)=evalf(subs(T=1000*K_,rhs(eqEQ3)));eqEQ3_3000K:=lhs(eqEQ3)=evalf(subs(T=3000*K_,rhs(eqEQ3))); |
![`/`(`*`(`^`(x[CO], 2)), `*`(x[CO2])) = `+`(`*`(1503452099., `*`(exp(`+`(`-`(`/`(`*`(20743.32452, `*`(K_)), `*`(T))))))))](images/p071_13.gif) |
![ln(`/`(`*`(`^`(x[CO], 2)), `*`(x[CO2]))) = `+`(21.13102970, `-`(`/`(`*`(20743.32452, `*`(K_)), `*`(T))))](images/p071_14.gif) |
![`/`(`*`(`^`(x[CO], 2)), `*`(x[CO2])) = 1.473595275](images/p071_15.gif) |
![`/`(`*`(`^`(x[CO], 2)), `*`(x[CO2])) = 1493433.207](images/p071_16.gif) |
a)•Determinar la composición de equilibrio, pensando que sólo se genera CO2.
| > | eq1;eqMIX(a*C+b*O2=[2,4]);sol1:=solve({eqNX,eqBC,eqBH,eqBO,eqBN,eqEQ1},{a,b,x[O2],x[CO2]});sol1_3000:=evalf(subs(T=3000*K_,sol1));plot(subs(sol1,SI0,[x[Comp[2]],x[Comp[4]]]),T=0..40000,xs=0..1,color=black); |
![{a = `+`(`/`(`*`(176841373., `*`(exp(`+`(`/`(`*`(47332.21074, `*`(K_)), `*`(T)))))), `*`(`+`(`*`(176841373., `*`(exp(`+`(`/`(`*`(47332.21074, `*`(K_)), `*`(T)))))), 125000000.)))), b = 1., x[CO2] = `+...](images/p071_19.gif) |
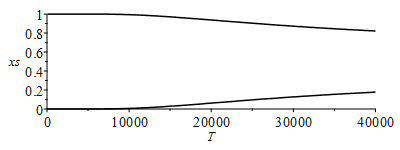 |
que indica que todo el O2 se gastaría para dar CO2 (hasta temperaturas fuera de validez, T>50000 K).
Si estudiásemos la producción exclusiva de CO, veríamos que no podría coexistir con el O2 a ninguna temperatura, en el equilibrio.
b)•Determinar la composición de equilibrio pensando que aparece CO2 y CO.
Podemos tratar de resolver las 3 incógnitas [xCO2,xCO,xO2], o pasar directamente a resolver [xCO2,xCO] sabiendo que xO2=0.
Por el primer camino:
| > | eq1;eq2;eqMIX(a*C+b*O2=[2,4,7]):eq1_:=lhs(eqEQ1)=e1:eq2_:=lhs(eqEQ2)=e2:sol1:=allvalues(solve({eqNX,eqBC,eqBO,eq1_,eq2_},{a,b,x[Comp[2]],x[Comp[4]],x[Comp[7]]}))[1]:sol1_500:=evalf(subs(e1=rhs(eqEQ1),e2=rhs(eqEQ2),T=500*K_,sol1));sol1_1000:=evalf(subs(e1=rhs(eqEQ1),e2=rhs(eqEQ2),T=1000*K_,sol1));sol1_12000:=evalf(subs(e1=rhs(eqEQ1),e2=rhs(eqEQ2),T=2000*K_,sol1));plot(subs(sol1,e1=rhs(eqEQ1),e2=rhs(eqEQ2),SI0,{x[Comp[4]],x[Comp[7]]}),T=0..2000,xs=0..1,color=black); |
 |
que enseña que el O2 se consume del todo (si hay bastante C) y en cambio el CO2 y el CO cambian de tono a unos 950 K.
Por el segundo camino bastaría resolver:
| > | eqNX:=1=x[Comp[4]]+x[Comp[7]];eqEQ3; |
![`/`(`*`(`^`(x[CO], 2)), `*`(x[CO2])) = `+`(`*`(1503452099., `*`(exp(`+`(`-`(`/`(`*`(20743.32452, `*`(K_)), `*`(T))))))))](images/p071_29.gif) |
El cruce es cuando xCO=xCO2=1/2 y T=950 K.
| > | solve(subs(x[CO]=1/2,x[CO2]=1/2,eqEQ3),T); |
| (1) |
| > |