| > | restart:#"m08_p02" |
En un recipiente de 5 litros, en una atmósfera a 90 kPa, 27 °C y 50% de humedad relativa, se vierten 3 litros de agua y a continuación se cierra herméticamente. Se pide:
a) Calcular la cantidad de vapor de agua en el instante inicial y en el equilibrio final.
b) Calcular el calor intercambiado con el exterior.
c) Calcular la producciĂłn de entropĂa en el proceso.
Posteriormente se calienta el recipiente hasta que la presiĂłn interior alcanza los 450 kPa. Se pide:
d) Suponiendo que el nivel de lĂquido apenas varĂa, calcular la temperatura alcanzada y la masa de agua evaporada.
e) Calcular el calor comunicado
Datos:
| > | read"../therm_eq.m":read"../therm_proc.m":with(therm_proc): |
| > | su1:="Aire":su2:="H2O":dat:=[Vtot=0.005*m_^3,T0=(27+273)*K_,p0=90e3*Pa_,phi0=0.5,Vliq1=0.003*m_^3,p3=450e3*Pa_]; |

Eqs. const.:
| > | Adat:=get_gas_data(su1):Adat:=subs(c[p]=c[pa],R=R[a],M=M[a],T[b]=nada,[Adat]):Wgdat:=get_gas_data(su2):Wgdat:=subs(c[p]=c[pv],R=R[v],M=M[v],[Wgdat]):Wldat:=get_gas_data(su2),get_liq_data(su2):Wdat:=op(Wgdat),Wldat:get_pv_data(su2):dat:=op(dat),Const,SI2,SI1: |
a) Calcular la cantidad de vapor de agua en el instante inicial y en el equilibrio final.
Primero el estado inicial.
| > | T1:=T0:p1:=p0:phi1:=phi0:n1:=p1*(Vtot-Vliq1)/(R[u]*T1);n1_:=subs(dat,dat,n1);xv1:='phi1*pv(T1)/p1';xv1_:=subs(dat,evalf(subs(dat,phi1*pv(T1)/p1)));nv1:='xv1*n1';nv1_:=xv1_*n1_;na1:='n1-nv1';na1_:=n1_-nv1_;w1_:=subs(dat,evalf(subs(dat,Adat,Wdat,w(phi1,T1,p1)))); |
i.e. inicialmente, en los 2 L de gases, hay 72 milimoles en total (nv1=1,4 mmol de vapor y el resto de aire seco).
Segundo, para el estado final, de equilibrio lĂquido-vapor, suponemos variaciĂłn de volumen y de presiĂłn despreciables:
| > | phi2:=1;T2:=T1;na2:='na1';xv2:='phi2*pv(T2)/p1';xv2_:=subs(dat,evalf(subs(dat,phi2*pv(T2)/p1)));nv2:='xv2*n1';nv2_:=xv2_*n1_;w2_:=subs(dat,evalf(subs(dat,Adat,Wdat,w(phi2,T2,p1)))); |
i.e. tras la saturaciĂłn hay el doble de vapor, nv2=2,9 mmol
ComprobaciĂłn de que DVliq=0 y Dp=0.
| > | DVliq12_:=subs(Adat,Wdat,na1_*M[a]*(w2_-w1_)/rho);p2_:='(na1+nv2)*R[u]*T2/(Vtot-Vliq1)';p2_:=subs(dat,subs(dat,dat,(na1_+nv2_)*R[u]*T2/(Vtot-Vliq1)));p2_p1_:=subs(dat,dat,p2_/p1); |
ConclusiĂłn: la humedad pasa del 50% (13 g/kg) al 100% (26 g/kg), aumentando la presiĂłn un 2% (desde 90,0 kPa hasta 91,8 kPa).
b) Calcular el calor intercambiado con el exterior.
Considerando el contenido total, el incremento de energĂa lo podemos separar en tres partes: la del lĂquido que queda lĂquido, la del que se vaporiza, y la de los gases iniciales.
| > | eq1_5;Q12:=DE12-W12;W12:=0;Q12:='nL*c[w]*DT12+na1*c[va]*DT12+nv1*c[vv]*DT12+(nv2-nv1)*M[v]*u[lv]';DT12:=0;u[lv]:='h[lv]-pvT0*(v[v]-v[l])';u[lv]:=h[lv]-R[v]*T0;pvT0_:=subs(dat,evalf(subs(dat,pv(T0)))):'pvT0'=evalf(%,2);h[lv]:=h[lv0]-(c-c[pv])*(T0-T[b]);h_[lv]:=evalf(subs(Wdat,dat,h[lv])):'h[lv]'=evalf(%,2);u_[lv]:=subs(Wdat,dat,u[lv]):'u[lv]'=evalf(%/(1e6*J_/MJ_),2);Q12_:=subs(SI2,SI1,subs(dat,Adat,Wdat,(nv2_-nv1_)*M[v]*u[lv])); |
i.e. recibe 58 J del ambiente. En lugar de calcular la energĂa interna de vaporizaciĂłn a esa temperatura, se podĂa haber aproximado directamente por la entalpĂa de ebulliciĂłn (a 100 ÂşC) que viene en las tablas:
| > | Q12:='(nv2-nv1)*M[v]*h[lvB]';h[lvB]=subs(Wdat,h[lv0]);Q12_:=subs(Wdat,(nv2_-nv1_)*M[v]*h[lv0]); |
c) Calcular la producciĂłn de entropĂa en el proceso.
Será la diferencia de entropĂas de mezclado (respecto a los gases sin mezclar). NĂłtese que no se genera entropĂa en la vaporizaciĂłn a temperatura ambiente, pues el incremento de entropĂa del H20 se compensa con la disminuciĂłn de entropĂa del entorno, en este caso lĂmite.
| > | Sgen_term:=0;Sgen_quim:='-R[u]*(na1_+nv2_)*(xv2_*ln(xv2_)+(1-xv2_)*ln(1-xv2_))+R[u]*(na1_+nv1_)*(xv1_*ln(xv1_)+(1-xv1_)*ln(1-xv1_))';Sgen_quim_:=subs(dat,Sgen_quim):'Sgen_quim'=evalf(%,1); |
Posteriormente se calienta el recipiente hasta que la presiĂłn interior alcanza los 450 kPa. Se pide:
d) Suponiendo que el nivel de lĂquido apenas varĂa, calcular la temperatura alcanzada y la masa de agua evaporada.
| > | phi3:=1;na3:='na2';eq1:='nv3/(na3+nv3)=pv(T3)/p3';eq2:='p3=(na3+nv3)*R[u]*T3/(Vtot-Vliq1)';eq1_:=subs(subs(dat,nv3/(na1_+nv3)=pv(T3)/p3));eq2_:=evalf(subs(subs(dat,eq2)));sol1_:=fsolve(subs(SI0,{eq1_,eq2_}),{nv3,T3},{T3=300..500});nv3_=subs(sol1_,nv3)*mol_;T3_:=subs(sol1_,T3)*K_;T3=TKC(T3_);Tvp3_:=evalf(subs(dat,solve(p3=pv(T),T)));'Tvp3_'=TKC(Tvp3_);mw23:='(nv3-nv2)*M[v]';mw23_:=subs(sol1_,dat,Wdat,(nv3*mol_-nv2_)*M[v]);xv3:='nv3/(na1+nv3)';xv3_:=subs(sol1_,nv3*mol_/(na1_+nv3*mol_));w3_:=subs(dat,evalf(subs(dat,Adat,Wdat,w(1,T3_,p3)))); |
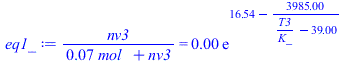 |
i.e. se calienta hasta 137 ÂşC (sin hervir, que a 450 kPa hervirĂa a 148 ÂşC, aunque pudiera hervir localmente cerca de la fuente de calor).
Aunque sĂłlo se evaporan 3,4 g de agua, la suposiciĂłn de nivel fijo no es tan buena, pues los 3 litros de lĂquido se dilatarĂan bastante de 27 ÂşC hasta 137 ÂşC (del orden del 7%).
e) Calcular el calor comunicado.
Basta considerar el de calentar el lĂquido, como podemos comprobar comparándolo con el de vaporizaciĂłn de la masa que pasa de lĂquido a T0 a vapor a T3.
| > | Q23:='mliq*cliq*(T3-T2)';Q23_:=subs(dat,Wdat,rho*Vliq1*c*(T3_-T2)):'Q23'=evalf(%/(1e6*J_/MJ_));Qvap:='(nv3-nv2)*M[v]*(c[L]*(T3-T2)+u[lvT3])';Qvap:='(nv3-nv2)*M[v]*(u[lvT0]+(c[pv]-R)*(T3-T2))';Qvap_:=subs(SI1,subs(sol1_,dat,Wdat,(nv3*mol_-nv2_)*M[v]*(u[lv]+(c[p]-R)*(T3_-T2)))); |
i.e. el interior ha recibido una energĂa de 1,4 MJ (calor comunicado neto). El calor para la evaporaciĂłn, despreciado, serĂa sĂłlo 8,4 kJ.
| > |