| > | restart:#"m07_p49" |
Considérese un gas natural que en estado líquido puede aproximarse como una mezcla de 99 % de metano en base molar, y el resto nitrógeno. Se pide:
a) Considerando los componentes puros, intervalo de temperaturas en el que serían líquidos a 100 kPa, indicando los valores en un diagrama de fases p-T.
b) Hacer un esquema de las fases de la mezcla mencionada (a 100 kPa) en un diagrama T-x, indicando los valores extremos, y calculando el punto de rocío y el de burbuja con el modelo de mezcla ideal.
c) Determinar la composición del gas generado en el punto de ebullición de la mezcla líquida.
Datos:
| > | read`../therm_eq.m`:read`../therm_const.m`:read`../therm_proc.m`:with(therm_proc):with(plots): |
| > | su1:="CH4":su2:="N2":dat:=[x1=0.99,p0=1e5*Pa_]; |
| > | g1dat:=get_gas_data(su1):l1dat:=get_liq_data(su1):g2dat:=get_gas_data(su2):l2dat:=get_liq_data(su2):dat1:=op(dat),g1dat,l1dat,Const,SI2,SI1:dat2:=op(dat),g2dat,l2dat,Const,SI2,SI1:pv1:=proc(T) global su1;get_pv_data(su1);RETURN(pv(T)):end:pv2:=proc(T) global su1;get_pv_data(su2);RETURN(pv(T)):end: |
Ecuaciones para mezclas bifásicas binarias ideales:
| > | eqNV:=xv1+xv2=1;eqNL:=xl1+xl2=1;eqC1:=xv1*xv0+xl1*xl0=x01;eqC2:=xv2*xv0+xl2*xl0=x02;eqE1:=xv1/xl1=pv1/p;eqE2:=xv2/xl2=pv2/p;sol1:=solve({eqNV,eqNL,eqE1,eqE2},{xv1,xv2,xl1,xl2});sol2:=solve({eqC1,eqC2},{xv0,xl0}); |
| (1) |
a) Considerando los componentes puros, intervalo de temperaturas en el que serían líquidos a 100 kPa, indicando los valores en un diagrama de fases p-T.
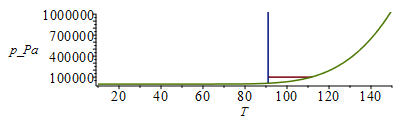
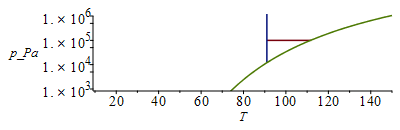
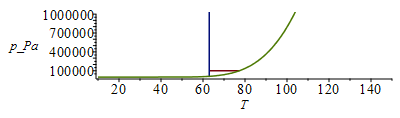
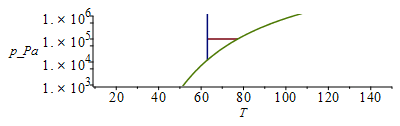
El intervalo líquido a 100 kPa será desde el punto de fusión normal hasta el punto de ebullición normal. Los valores se obtienen de las Tablas de propiedades. Aunque bastaría hacer un esquema del diagrama de fases de una substancia pura, se presentan aquí los diagramas a escala (lineal y logarítmica en presión).
|
Tf |
Tb |
Metano |
91 K |
112 K |
Nitrógeno |
63 K |
77 K |
Sea 1=metano y 2=nitrógeno.
Tb1:=subs(dat1,T[b]);Ttr1:=subs(dat1,T[f]);ptr1:=pv1(%);plot([[[Ttr1/K_,1e5],[Tb1/K_,1e5]],[[Ttr1/K_,ptr1/Pa_],[Ttr1/K_,1e7]],pv1(T*K_)/Pa_],T=10..150,p_Pa=1e3..1e6);;logplot([[[Ttr1/K_,1e5],[Tb1/K_,1e5]],[[Ttr1/K_,ptr1/Pa_],[Ttr1/K_,1e7]],pv1(T*K_)/Pa_],T=10..150,p_Pa=1e3..1e6);Tb2:=subs(dat2,T[b]);Ttr2:=subs(dat2,T[f]);ptr2:=pv2(%);plot([[[Ttr2/K_,1e5],[Tb2/K_,1e5]],[[Ttr2/K_,ptr2/Pa_],[Ttr2/K_,1e7]],pv2(T*K_)/Pa_],T=10..150,p_Pa=1e3..1e6);logplot([[[Ttr2/K_,1e5],[Tb2/K_,1e5]],[[Ttr2/K_,ptr2/Pa_],[Ttr2/K_,1e7]],pv2(T*K_)/Pa_],T=10..150,p_Pa=1e3..1e6);
 |
|
 |
|
 |
|
 |
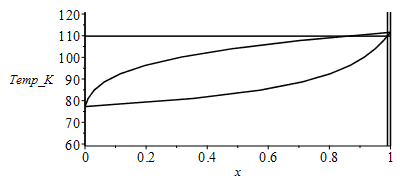
b) Hacer un esquema de las fases de la mezcla mencionada (a 100 kPa) en un diagrama T-x, indicando los valores extremos, y calculando el punto de rocío y el de burbuja.
Hay que resolver las ecuaciones de Raoult, con x1=xv1 para el punto de rocío (condensación), y con x1=x1l para el de burbuja (ebullición).
| > | Tcond_:=fsolve(subs(sol1,p=p0,pv1=pv1(T),pv2=pv2(T),dat,SI0,x1=xv1),T=50..150)*K_;Tboil_:=fsolve(subs(sol1,p=p0,pv1=pv1(T),pv2=pv2(T),dat,SI0,x1=xl1),T=50..150)*K_; |
| (2) |
Podemos graficar toda la curva de rocío y la de burbuja.
| > | N:=9:pl1_:=[[1,T1]]:pl2_:=[[1,T1]]:T1:=evalf(subs(dat,solve(p0=pv1(T),T)));T2:=evalf(subs(dat,solve(p0=pv2(T),T))); for i from 1 to N-1 do T[i]:=T1+(T2-T1)*(i/N);pv1_:=pv1(T[i]);pv2_:=pv2(T[i]);xv1_[i]:=subs(sol1,p=p0,pv1=pv1_,pv2=pv2_,dat,xv1);xl1_[i]:=subs(sol1,p=p0,pv1=pv1_,pv2=pv2_,dat,xl1);pl1_:=[op(pl1_),[xv1_[i],T[i]]];pl2_:=[op(pl2_),[xl1_[i],T[i]]];print(T[i],pv1_,pv2_,xv1_[i],xl1_[i]);od:pl1_:=[op(pl1_),[0,T2]]:pl2_:=[op(pl2_),[0,T2]]:plot(subs(dat,SI0,{pl1_,pl2_,[[1,0],[1,150]],[[x1,0],[x1,150]],[[0,0],[0,150]],[[0,Tboil_],[1,Tboil_]]}),x=0..1,'Temp_K'=60..120,color=black); |
 |
c) Determinar la composición del gas generado en el punto de ebullición de la mezcla líquida.
| > | xv2_boil:=subs(sol1,p=p0,pv1=pv1(Tboil_),pv2=pv2(Tboil_),dat,xv2); |
| (3) |
i.e. el primer vapor que se genera en la ebullición de esta mezcla líquida con 1 % de N2, tiene 15 % de N2 (85 % de CH4). Puede apreciarse esta segregación en el diagrama T-x anterior (para T=Tboil=110 K).
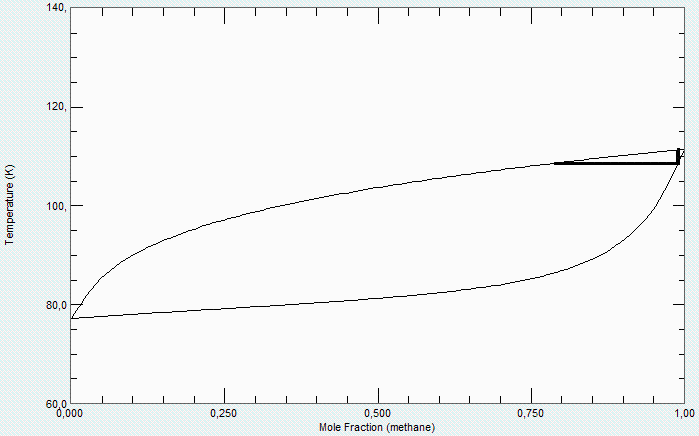
Se adjunta el diagrama T-x más preciso conocido (del NIST) para comparar la bondad del modelo de mezcla ideal. El valor real es xv2_boil=0,22 (78 % de CH4).
Nótese que, a 100 kPa:
-El metano puro solo puede estar en estado bifásico a -162 ºC (-161,6 ºC, 111,5 K).
-Las mezclas con 1 % de N2 solo son bifásicas entre -162 ºC y -165 ºC (alrededor de 110 K).
-Cuando la mezcla líquida con 1 % de N2 empieza a vaporizarse (a Tb=-165 ºC), el vapor contiene un 22 % de N2 (y solo un 78 % de CH4).
-Si se enfría ese vapor con 22 % de N2, empieza a condensar a Tdew=-165 ºC, pero no acabaría de condensar hasta -187 ºC (86 K)
| > |