| > | restart:#"m15_p51" |
| > | read`../therm_eq.m`:read`../therm_chem.m`:with(therm_chem);with(therm_proc): |
Hacia 1780, Volta desarrolló un eudímetro (una especie de probeta de vidrio grueso) para determinar la concentración de oxígeno en aires viciados mediante la combustión con exceso de hidrógeno. El procedimiento era tal que así: se llenaba el eudímetro con mercurio y se colocaba invertido sobre un baño de mercurio (como en el experimento de Torricelli), luego se introducía por la boca (a través de un tubo acodado) el aire a analizar, e.g. hasta completar 100 cm3 en la probeta, y luego hidrógeno (obtenido por reacción de un metal con una disolución ácida) hasta completar 200 cm3 en total; finalmente se provocaba la combustión con una chispa en el extremo superior (entre electrodos previamente instalados al efecto), y al final quedaban e.g. 170 cm3 de gases ya atemperados. Las dimensiones del eudímetro eran: 50 cm de largo, 4 cm de diámetro interior, 1 cm de espesor, y se sumergía 1 cm en el baño Se pide:
a) Hacer un esquema de la configuración antes y después de la combustión.
b) Plantear la reacción de combustión para la mezcla, indicando las hipótesis necesarias.
c) Determinar las cantidades molares de los gases descritos.
d) Determinar la concentración de oxígeno en el aire usado.
e) Determinar la cantidad de agua formada.
Datos:
| > | fuel:=H2;su1:="Hg":su2:="H2O":dat:=[VA=100e-6*m_^3,VAF=200e-6*m_^3,L=(0.50-0.01)*m_,D=0.04*m_,VG=170e-6*m_^3]:A_:=evalf(subs(dat,Pi*D^2/4)):dat:=[A=A_,op(dat)]; |
Eqs. const.:
| > | dat:=op(dat),op(subs(g=g0,[Const])),SI2,SI1:Hgdat:=get_liq_data(su1):Wdat:=get_gas_data(su2),get_liq_data(su2):get_pv_data(su2): |
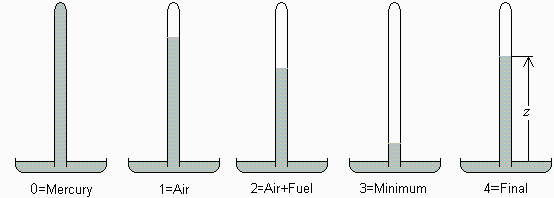
a) Hacer un esquema de la configuración antes y después de la combustión.
b) Plantear la reacción para la mezcla, indicando las hipótesis necesarias.
| > | eqMIX_:=eqMIX(a*fuel+b*O2+c*N2=[3,5,8]); |
Se ha de suponer que el aire a ensayar no tiene más oxidante que el oxígeno, y ningún combustible.
Suponemos combustión completa con exceso de hidrógeno, i.e. que todo el oxígeno se reduce.
Suponemos despreciable la cantidad de agua en fase gaseosa al final (y al principio, ¡pero no tras la combustión!)
Suponemos despreciable la presión de vapor del mercurio.
c) Determinar las cantidades molares de los gases descritos.
Sea z la altura del nivel de mercurio respecto a la del baño. El espacio de trabajo está en depresión.
| > | z1:=(L*A-VA)/A;p1:='p0-rho*g*z1';z1_:=subs(dat,z1);p1_:=subs(g=g0,Hgdat,dat,p1);n1:='p1*VA/(R[u]*T0)';n1_:=subs(Const,Hgdat,dat,n1);z2:=(L*A-VAF)/A;p2:='p0-rho*g*z2';z2_:=subs(dat,z2);p2_:=subs(g=g0,Hgdat,dat,p2);n2:='p2*VAF/(R[u]*T0)';n2_:=subs(Const,Hgdat,dat,n2);nH:='n2-n1';nH_:=n2_-n1_;z4:=(L*A-VG)/A;p4:='p0-rho*g*z4';z4_:=subs(dat,z4);p4_:=subs(g=g0,Hgdat,dat,p4);n4:='p4*VG/(R[u]*T0)';n4_:=subs(Const,Hgdat,dat,n4); |
i.e. hay nA=n1=1.9e-3 mol de aire, nAF=n2=4.7e-3 mol de aire+hydrógeno (i.e. nH=2.8e-3 mol de H2), y al final quedan nG=n4=3.8e-3 mol de productos gaseosos (N2+H2+H2Ovapor).
d) Determinar la concentración de oxígeno en el aire usads.
| > | eqDatA:=(b+c)/a='n1/nH';eqDatA_:=(b+c)/a=n1_/nH_:evalf(%,2);eqDatG:='(x[N2]+x[H2])/a=n4/nH';eqDatG_:=(x[N2]+x[H2])/a=n4_/nH_;eqBH_:=eqBH;eqBO_:=eqBO;eqBN_:=eqBN;eqNX_:=eqNX;sol1_:=solve({eqNX_,eqDatA_,eqDatG_,eqBH_,eqBO_,eqBN_},{a,b,c,x[N2],x[H2],x[H2O]});xO2_Air:='b/(b+c)';xO2_Air_:=subs(sol1_,%):'xO2_Air'=evalf(%,2); |
i.e. b/(b+c)=0,16 moles de oxígeno por mol de aire (menos que en aire puro, que es 21%).
Por otra parte, la cantidad total de productos es nH/a=0.0044 mol, repartidos en fase gaseosa y en fase líquida.
e) Determinar la cantidad de agua formada
Se ha supuesto que los xH2O=0,62e-3 moles de agua condensaban, ocupando un volumen que hemos despreciado, pero que podemos calcular así:
| > | eqP:=a='nH/nP';eqP_:=nP=subs(sol1_,nH_/a);eqW:=n[H2O]=x[H2O]*nP;eqW_:=subs(eqP_,sol1_,eqW);DzW:=n[H2O]*M/(rho*A);DzW_:=subs(eqW_,sol1_,Wdat,dat,n[H2O]*M/(rho*A)):'DzW'=evalf(%*1000*mm_/m_); |
Efectivamente el espesor de la capa de condensado era despreciable (y eso que se ha supuesto que no han quedado gotitas adheridas a las paredes).
Se ha supuesto también que la cantidad de agua en fase gaseosa era desprecible, pero podemos calcularla así:
| > | eqWvapour:=n[H2O,v]/(n[H2]+n[N2]+n[H2O,v])=p[v,H2O,T0]/p4;eqWvapour_:=evalf(subs(dat,n[H2O,v]/(n[H2]+n[N2]+n[H2O,v])=pv(T0)/p4_)); |
![`/`(`*`(n[H2O, v]), `*`(`+`(n[H2], n[N2], n[H2O, v]))) = `/`(`*`(p[v, H2O, T0]), `*`(`+`(p0, `-`(`/`(`*`(rho, `*`(g, `*`(`+`(`*`(L, `*`(A)), `-`(VG))))), `*`(A))))))](images/p51_43.gif) |
i.e. sólo un 3,2% de los 0,62e-3 mol de H2O estarían en fase gaseosa, despreciable frente a los nG=3,8e-3 mol.
ADICIONAL.
f) Estimar el volumen máximo de gases tras la combustión
Supondremos que no da tiempo a enfriarse (combustión adiabática y toda el agua gaseosa)
Habría que calcular la temperatura y la presión tras la combustión adiabática a volumen constante, y luego estudiar el movimiento de la columna de mercurio y la burbuja de gas, supuesta de la composición anterior invariable. Como esto es complicado (la masa equivalente de mercurio varía), una cruda aproximación de orden de magnitud podría ser la del volumen que ocuparían los gases quemados expandidos isoentrópicamente hasta la presión ambiente, con una gamma=1.3.
| > | i:='i':PCI_:=PCI(H2+(1/2)*O2=H2O);Tad:=T25+(a-x[H2])*PCI/sum(delta[i]*x[Comp[i]]*c[p,Comp[i]],i=1..C_);Tad_:=subs(PCI=PCI_,cpComp,sol1_,dat,%);p_Vconst:='nP*R[u]*Tad_/VAF';p_Vconst_:=subs(eqP_,sol1_,dat,%);Tad_p0:='Tad_*(p0/p_Vconst)^((gamma-1)/gamma)';Tad_p0_:=subs(gamma=1.4,sol1_,eqP_,dat,%);z3:='L-nP*R[u]*Tad_p0/(p0*A)';z3_:=subs(gamma=1.4,sol1_,eqP_,dat,z3):'z3'=evalf(%,2); |
i.e. el nivel bajaría hasta 20 cm por encima del baño (21 cm por encima de la boca), luego no hay peligro de que se escapen los gases).
| > |