| > | restart:#"m09_p39" |
La hidracina es un líquido incoloro y oleoso, con un olor similar al del amoníaco, que se utiliza como propulsante en cohetes. Se pide:
a) Calcular las entalpía y entropía estándares para la reacción de descomposición total N2H4=N2+2H2, interpretando el signo obtenido.
b) Calcular las entalpía y entropía estándares para la reacción de descomposición N2H4=(4/3)NH3+(1/3)N2, interpretando el signo obtenido.
c) Calcular la temperatura adiabática de la reacción N2H4=N2+2H2 a 100 kPa. Influencia de la presión.
d) Calcular la temperatura adiabática de la reacción N2H4=(4/3)NH3+(1/3)N2, tomando un valor medio de cp,NH3=60 J/(mol•K).
e) En la práctica, el NH3 formado se descompone parcialmente a alta temperatura, dependiendo del catalizador usado. Calcular las entalpía y entropía estándares para la reacción de descomposición NH3=(1/2)N2+(3/2)H2, interpretando el signo obtenido.
f) Calcular la temperatura adiabática de la reacción N2H4=NH3+(1/2)N2+(1/2)H2.
Datos:
| > | read`../therm_chem.m`:with(therm_chem);with(therm_proc): |
| > | su1:="N2H4":su2:="NH3":su3:="N2":su4:="H2":dat:=[cpNH3=60*J_/(mol_*K_)]: |
Eqs. const.:
| > | dat:=op(dat),op(subs(g=g0,[Const])),SI2,SI1:datN2cold:=get_gas_data(su3):datH2cold:=get_gas_data(su4): |
a) Calcular las entalpía y entropía estándares para la reacción de descomposición total N2H4=N2+2H2, interpretando el signo obtenido.
| > | eq1:=N2H4=N2+2*H2;hgsN2H4:=get_hgs_data("N2H4(l)");hgsN2:=get_hgs_data("N2(g)");hgsH2:=get_hgs_data("H2(g)");hr1_std:=h[f,N2]+2*h[f,H2]-h[f,N2H4];hgs_:=hgs_r25(eq1); |
i.e. la entalpía de reacción estándar es de -50 kJ/mol, indicando el signo '-' que se trata de una reacción exotérmica. La entropía de reacción estándar es de 330 J/(mol·K), indicando el signo '+' que la entropía aumenta y mucho (un mol de líquido da tres moles de gas).
b) Calcular las entalpía y entropía estándares para la reacción de descomposición N2H4=(4/3)NH3+(1/3)N2, interpretando el signo obtenido.
| > | eq2:=N2H4=(4/3)*NH3+(1/3)*N2;hgsNH3:=get_hgs_data("NH3(g)");hr2_std:=(4/3)*h[f,NH3]+(1/3)*h[f,N2]-h[f,N2H4];hgs_:=hgs_r25(eq2); |
i.e. la entalpía de reacción estándar es de -112 kJ/mol, indicando el signo '-' que se trata de una reacción exotérmica. La entropía de reacción estándar es de 200 J/(mol·K), indicando el signo '+' que la entropía aumenta mucho (un mol de líquido da 5/3=1,7 moles de gas).
La exotermicidad de esta reacción en mayor que la anterior porque la entalpía de formación del NH3 es negativa, i.e. al formarse se libera más energía.
c) Calcular la temperatura adiabática de la reacción N2H4=N2+2H2 a 100 kPa. Influencia de la presión.
Se supone que entra al reactor a 25 ºC.
| > | eq1;Tad:=T25+PCI/(c[p,N2]+2*c[p,H2]);PCI_:=PCI(eq1);eqM_:=eqMIX(a*N2H4=[3,8]);sol_:=solve({eqBN,eqBH,eqNX},{a,x[N2],x[H2]});eq15_7_2;cps:=[cpComp[3],cpComp[8]];subs(PCI=PCI_,sol_,cpComp,dat,eq15_7_3);cps:=[c[p,N2]=subs(datN2cold,c[p]*M),c[p,H2]=subs(datH2cold,c[p]*M)];subs(PCI=PCI_,sol_,cps,dat,eq15_7_3); |
![Ta = `+`(T25, `/`(`*`(a, `*`(PCI)), `*`(Sum(`*`(x[Com[i]], `*`(c[p, i])), i = 1 .. CP))))](images/p39_17.gif) |
i.e. en la reacción completa queda un 33% de N2 y un 67% de H2, que con unos valores medios en caliente de los cp de 34 J/(mol·K), se calentarían hasta 790 K, pero como esta temperatura no es muy alta, aplicamos los valores de cp en frío, resultando una temperatura adiabática de unos 890 K.
La presión apenas influye (en el PCI nada, y en los cp muy poco); se entiende que la presión es superior a la de vaporización de la hidracina a 25 ºC (1,9 kPa) para que entre en estado líquido.
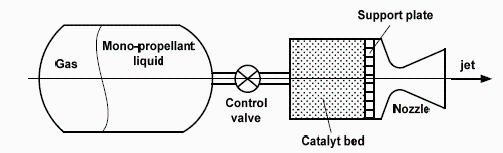
NOTA. Los cohetes de hidracina son los más usados en propulsión espacial, desde los cohetes de aterrizaje y despegue del Apolo en la Luna, hasta los pequeños cohetes de control de actitud en Ariane, Meteosat...
El empuje se obtiene al introducir la hidracina líquida (que está almacenada en un depósito con membrana flexible presurizada con un gas inerte) en una cámara con catalizador, donde se descompone, saliendo los gases por la tobera a unos 2500 m/s. La presión de funcionamiento en la cámara de reacción suele ser 0.5..2 MPa. El catalizador es una matriz porosa (e.g. de alúmina) impregnada con algún metal noble (e.g. iridio), o con un oxi-carburos de metales de transición como el wolframio.
Pero la descomposición de la hidracina no es según N2H4=N2+2H2, sino que se forma amoniaco.
d) Calcular la temperatura adiabática de la reacción N2H4=(4/3)NH3+(1/3)N2, tomando un valor medio de cp,NH3=60 J/(mol•K).
| > | eq2;PCI_:=PCI(eq2);eqM_:=eqMIX(a*N2H4=[3,37]);sol_:=solve({eqBN,eqBH,eqNX},{a,x[N2],x[NH3]});eq15_7_2;subs(PCI=PCI_,sol_,c[p,NH3]=cpNH3,cpComp,dat,eq15_7_3); |
![Ta = `+`(T25, `/`(`*`(a, `*`(PCI)), `*`(Sum(`*`(x[Com[i]], `*`(c[p, i])), i = 1 .. CP))))](images/p39_26.gif) |
i.e. ahora, con un poder calorífico mucho mayor, PCI=112 kJ/mol, con menos cantidad de gases (1,67 mol de productos por cada mol de propulsante), pero con uno de los gases tetra-atómico, cp=60 J/(mol·K), en la reacción adiabática se alcanzarían unos 1530 K.
e) En la práctica, el NH3 formado se descompone parcialmente a alta temperatura, dependiendo del catalizador usado. Calcular las entalpía y entropía estándares para la reacción de descomposición NH3=(1/2)N2+(3/2)H2, interpretando el signo obtenido.
| > | eq3:=NH3=(1/2)*N2+(3/2)*H2;hgs_:=hgs_r25(eq3); |
i.e. la entalpía de reacción estándar es de 46 kJ/mol, indicando el signo '+' que se trata de una reacción endotérmica. La entropía de reacción estándar es de 99 J/(mol·K), indicando el signo '+' que la entropía aumenta (un mol de gas da dos moles de gas).
Por tanto, en la práctica, al descomponerse el NH3 disminuirá la temperatura adiabática de la descomposición de la hidracina.
f) Calcular la temperatura adiabática de la reacción N2H4=NH3+(1/2)N2+(1/2)H2.
Si la fracción final de amoniaco fuese del 50%:
| > | eq4:=N2H4=NH3+(1/2)*N2+(1/2)*H2;hgs_:=hgs_r25(eq4);PCI_:=PCI(eq4);eqM_:=eqMIX(a*N2H4=[3,8,37]);sol_:={a=1/2,x[NH3]=1/2,x[N2]=1/4,x[H2]=1/4};eq15_7_2;subs(PCI=PCI_,sol_,c[p,NH3]=cpNH3,cpComp,dat,eq15_7_3); |
![Ta = `+`(T25, `/`(`*`(a, `*`(PCI)), `*`(Sum(`*`(x[Com[i]], `*`(c[p, i])), i = 1 .. CP))))](images/p39_35.gif) |
i.e. la Ta bajaría de 1530 K a 1330 K.
| > |