| > | restart:#"m04_p41" |
Se tienen dos botellas de 5 litros conteniendo respectivamente metano y etano a temperatura ambiente (unos 20 ºC), indicando sus manómetros 15 MPa y 3,6 MPa, respectivamente, se pide:
a) Estimar la masa contenida en cada caso, indicando la incertidumbre esperada (teniendo en cuenta la incertidumbre en los datos).
b) Hacer un esquema en un diagrama p-h de la evolución que supondría pasar de 20 ºC a 40 ºC.
c) Determinar los nuevos estados termodinámicos a 40 ºC.
Datos:
| > | read"../therm_eq.m":read"../therm_proc.m":with(therm_proc): |
| > | su1:="CH4":su2:="C2H6":dat:=[V=5e-3*m_^3,T0=(20+273)*K_,p1=(15+0.1)*1e6*Pa_,p2=(3.5+0.1)*1e6*Pa_,T0new=(40+273)*K_]; |
Eqs. const.:
| > | dat:=op(dat),Const,SI2,SI1:dat1:=get_gas_data(su1),get_liq_data(su1):pv1:=get_pv_data(su1):dat2:=get_gas_data(su2),get_liq_data(su2):pv2:=get_pv_data(su2): |
a) Estimar la masa contenida en cada caso, indicando la incertidumbre esperada (teniendo en cuenta la incertidumbre en los datos).
Hay que determinar si está en estado gaseoso o licuado, a esa presión y temperatura.
La incertidumbre en los datos se puede suponer que es:
-Pequeña en el volumen, pues se tratará de botellas previamente taradas (e.g. entre 4,95 L y 5,05 L, lo que supone un 1/500=0,2%).
-Medio grado en temperatura, i.e. entre 19,5 ºC y 20,5 ºC (lo que supone un 1/293=0,3% en valores absolutos), aunque lo de unos 20 ºC invita a considerar una mayor incertidumbre.
-Para la presión, hay que llevar cuidado porque se trata de valores manométricos, luego, lo primero que hay que hacer es añadirle la presión atmosférica, que supondremos que es de 0,1 MPa, aunque suele ser menor. Por tanto, ntre 14,6 MPa y 15,6 MPa para el metano (un 1/15=7%), y entre 3,6 MPa y 3,8 MPa para el etano (un 1/37=3%).
METANO.
Sabemos que no es licuable a temperatura ambiente y que por eso hay buques metaneros (LNG tankers).
| > | Tcr1:=subs(dat1,T[cr]); |
luego, efectivamente, no puede haber equilibrio líquido-vapor a 20 ºC (293>191), y se trata de un gas, cuya masa será, con el modelo de gas ideal, m=pV/(RT), o más exactamente, m=pV/ZRT) si los efectos de compresibilidad son importantes.
Z se mira en el diagrama de estados correspondientes adjunto (punto 1).
| > | m1_MGI:=p*V/(R*T);m1_MGI_:=subs(dat1,dat,p1*V/(R*T0));pR1:=subs(dat1,dat,p1/p[cr]);TR1:=subs(dat1,dat,T0/T[cr]);Z1:=0.82;m1_MEC:=p*V/(Z*R*T);m1_MEC_:=subs(dat1,dat,p1*V/(Z1*R*T0)); |
i.e., la masa de metano debe ser de unos 0,6 kg, con una incertidumbre estimada del 10%, a juzgar por la precisión en los datos (0,2% en V, 0,3% en T, 6% en p), en la medida de Z (2%), en la bondad del método (tal vez un 2% en esa región), y en otros incontables (e.g. ¿cuánto de puro es el metano?).
ETANO
Del etano es fácil que no se sepa casi nada. Mirando en las tablas:.
| > | Tcr2:=subs(dat2,T[cr]); |
luego, como está por debajo del punto crítico (288<305), pudiera estar líquido si la presión es alta. Si calculamos la presión de vapor a esa temperatura por Antoine, obtenemos:
| > | pv2:=p[v](T0);pv2_:=subs(dat,evalf(subs(dat,pv(T0)))); |
luego, si la presión fuese menor de 3,7 MPa (la manométrica <3,6 MPa), sólo habría. Aunque aquí parece que éste es el caso (3,5<3,6), no es probable que así sea, porque está muy cerca de la saturación, y lo normal es que haya líquido, así que tal vez la medida de la temperatura o de la presión no fueron muy finas (ya la ecuación de la presión de vapor de Antoine puede tener incertidumbres de hasta un 3%).
Conclusión: lo más probable es que esté casi llena de líquido y su masa sea algo menor de rholiq*V (por el margen de seguridad que siempre se deja al llenar con líquido), pero cabría la posibilidad de que estuviese vacía (sin líquido), por lo que la incertidumbre es enorme (bastaría moverla un poco para ver si suena al chapotear el líquido, y tal vez sopesarla).
| > | m2_MGI:=p*V/(R*T);m2_MGI_:=subs(dat2,dat,p2*V/(R*T0));m2_MLI:=rho*V;m2_MLI_:=subs(dat2,dat,%); |
También se puede resolver este caso con el MEC, tratando de determinar Z en el diagrama adjunto, pero se ve que la incertidumbre no permite resolver si está a un lado o a otro de la vertical por pR=0,74.
| > | pR2:=subs(dat2,dat,p2/p[cr]);TR2:=subs(dat2,dat,T0/T[cr]);Z2gas:=0.54;Z2liq:=0.11;m2_MEC:=p*V/(Z*R*T);m2_MEC_gas:=subs(Z=Z2gas,dat2,dat,p2*V/(Z*R*T0));m2_MEC_liq:=subs(Z=Z2liq,dat2,dat,p2*V/(Z*R*T0)); |
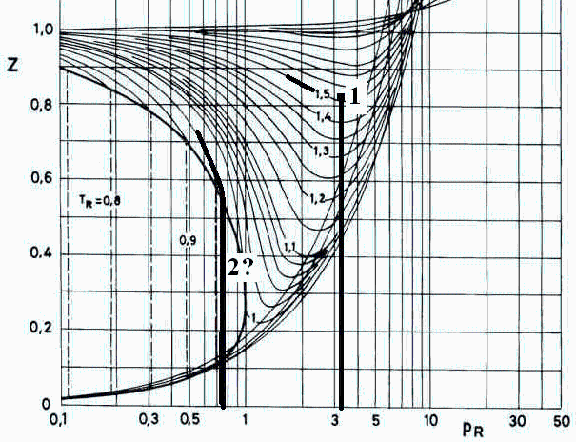
i.e., la masa de etano estará entre 0,4 kg si sólo queda gas, y 2 kg si estubiera casi llena de líquido (2,8 kg con el MLI, pero el MEC puede ser mejor en estas condiciones, aun a pesar de que la incertidumbre del MEC en la región líquida es muy alta, digamos del 20% o más). Para determinar 'exactamente' la masa contenida, se necesitaría la tara (masa de la botella vacía, que suele venir grabada en la botella) y el peso total, aunque una estimación grosera puede obtenerse sopesándola o agitándola para ver cómo suena el chapoteo del líquido.
b) Hacer un esquema en un diagrama p-h de la evolución que supondría pasar de 20 ºC a 40 ºC.
Se trata de una evolución a volumen constante (y masa constante).
METANO. No hay problema; incluso el modelo de gas ideal dará una aproximación aceptable.
ETANO. Se supera la temperatura crítica, luego desaparecería la entrefase líquido-vapor, y el resultado sería siempre fluido supercrítico, pero el resultado final dependerá de cuanto líquido hubiera al principio. En la figura adjunta se esquematiza que el incremento de presión crece bastante con la cantidad de líquido, y podría romperse la botella (suelen diseñarse para aguantar bien hasta 50 ºC, y luego suele disponerse una válvula de seguridad para que el colapso no sea estrepitoso).
| > |
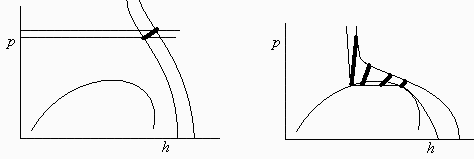
c) Determinar los nuevos estados termodinámicos a 40 ºC.
METANO. Gas, algo más comprimido.
| > | eq1:=p1*V/('Z1'*R*T0)=p1new*V/(Z1new*R*T0new);p1new_MGI:=p1*T0new/T0;p1new_MGI_:=subs(dat1,dat,p1new_MGI); |
i.e., con el MGI pasaría de 15,1 MPa a 16,2 MPa (no es de esperar que las correcciones por compresibilidad alteren el resultado).
ETANO. Estaría en estado supercrítico, con una presión que depende de la masa inicial. La ecuación a resolver es Dm=0 con V=cte.
Si inicialmente sólo había vapor saturado (m2=0,4 kg):
| > | T0new=subs(dat,T0new);Tcr2:=subs(dat2,T[cr]);eq2:=0=m2-p2new*V/(Z2new*R*T0new); |
Supongo p2new=4 MPa y miro en el gráfico del MEC.
| > | p2new:=4e6*Pa_;pR:=subs(dat2,p2new/p[cr]);TR:=subs(dat2,dat,T0new/T[cr]);Z2new:=0.65;eq2_:=subs(m2=0.4*kg_,dat2,dat,eq2); |
Supongo p2new=5 MPa y miro en el gráfico del MEC.
| > | p2new:=5e6*Pa_;pR:=subs(dat2,p2new/p[cr]);TR:=subs(dat2,dat,T0new/T[cr]);Z2new:=0.45;eq2_:=subs(m2=0.4*kg_,dat2,dat,eq2); |
de donde se deduce, interpolando linealmente, que la nueva presión es de 4,2 MPa. Los valores más exactos disponibles (NIST) dan una masa de vapor saturado de 0,429 kg y una presión a 40 ºC de 4,49 MPa.
Si inicialmente había un 85% en volumen de líquido (no suele llenarse para dejar margen de dilatación), la masa sería m2=0.85·2=1,7 kg, y la presión final:
Supongo p2new=5 MPa y miro en el gráfico del MEC.
| > | p2new:=5e6*Pa_;pR:=subs(dat2,p2new/p[cr]);TR:=subs(dat2,dat,T0new/T[cr]);Z2new:=0.45;eq2_:=subs(m2=1.7*kg_,dat2,dat,eq2); |
Supongo p2new=6 MPa y miro en el gráfico del MEC.
| > | p2new:=6e6*Pa_;pR:=subs(dat2,p2new/p[cr]);TR:=subs(dat2,dat,T0new/T[cr]);Z2new:=0.28;eq2_:=subs(m2=1.7*kg_,dat2,dat,eq2); |
Supongo p2new=8 MPa y miro en el gráfico del MEC.
| > | p2new:=8e6*Pa_;pR:=subs(dat2,p2new/p[cr]);TR:=subs(dat2,dat,T0new/T[cr]);Z2new:=0.29;eq2_:=subs(m2=1.7*kg_,dat2,dat,eq2); |
Supongo p2new=10 MPa y miro en el gráfico del MEC.
| > | p2new:=10e6*Pa_;pR:=subs(dat2,p2new/p[cr]);TR:=subs(dat2,dat,T0new/T[cr]);Z2new:=0.30;eq2_:=subs(m2=1.7*kg_,dat2,dat,eq2); |
o sea, unos 8,6 MPa, interpolando linealmente.
Los valores más exactos disponibles (NIST) para un 85% en volumen de líquido, dan 1,4 kg de etano (en vez de los 1,7 kg calculados con el MEC), y la presión pasaría de los 3,75 MPa a 20 ºC a una presión de 6,38 MPa a 40 ºC (casi un 30% inferior a los 8,6 MPa calculados con el MEC).
Este problema hubiese sido muchísimo más sencillo si se hubiera dispuesto de los diagrama (e.g. p-h) de las propiedades de cada sustancia.
| > |