| > | restart:#"m16_p19" |
| > | read`../therm_eq.m`:read`../therm_chem.m`:with(therm_chem);with(therm_proc): |
Una manera novedosa de aprovechar el calor de los gases de escape de una turbina de gas, consiste en usarlo para aumentar el poder calorífico del combustible mediante una rectificación termoquímica que aquí se va a modelizar del modo siguiente.
Se considera la mezcla reactante de metano y vapor de agua a presión y temperatura constantes (100 kPa y 1000 K), para la producción de hidrógeno y monóxido de carbono. Se pide:
a) Establecer las ecuaciones de estequiometría y de mezcla en función de las cantidades de reactivos usadas, por unidad de cantidad de substancia de gases de salida..
b) Establecer las ecuaciones de equilibrio químico y evaluarlas.
c) Determinar la composición de salida en función de la de entrada, particularizando para el caso de entrada equimolar.
d) Calcular el incremento de poder calorífico de los gases de salida respecto a los de entrada para el caso anterior.
Datos:
| > | su1:="Aire":su2:="H2O":fuel:=CH4;dat:=[Mf_=0.016*kg_/mol_,p1=100e3*Pa_,T1=1000*K_]; |
Eqs. const.:
| > | Adat:=get_gas_data(su1):Wdat:=get_gas_data(su2),get_liq_data(su2):get_pv_data(su2):dat:=op(dat),op(subs(g=g0,[Const])),Adat,SI2,SI1: |
a) Establecer las ecuaciones de estequiometría y de mezcla en función de las cantidades de reactivos usadas, por unidad de cantidad de substancia de gases de salida..
| > | eqST:=eq_fit(a*CH4+b*H2O=c*H2+d*CO);eqM:=subs(q=qq,eqMIX(a*CH4+b*H2O=[5,7,8,10]));sol1_:=evalf(solve(subs(dat,{eqNX,eqBC,eqBH,eqBO}),{x[Comp[5]],x[Comp[7]],x[Comp[8]],x[Comp[10]]})); |
b) Establecer las ecuaciones de equilibrio químico y evaluarlas.
| > | eqST:=CH4+H2O=3*H2+CO;eqEQ_:=evalf(subs(p=p1,T=T1,dat,eqEQ(CH4+H2O=3*H2+CO))):evalf(%,2); |
c) Determinar la composición de salida en función de la de entrada, particularizando para el caso de entrada equimolar.
| > | eqDat:=a=b;b_:=fsolve(subs(sol1_,eqDat,eqEQ_),b);eqDat_:=subs(b=b_,eqDat);sol1__:=subs(b=b_,eqDat_,sol1_); |
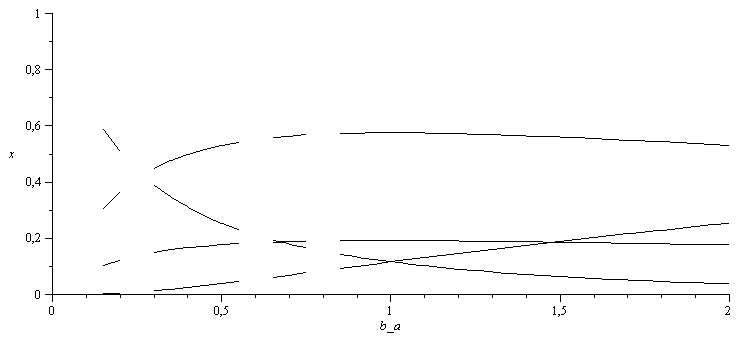
En función de la relación vapor/metano, b/a=b_a, las fracciones molares de equilibrio serían:
| > | a_:=proc(b_a) fsolve(subs(sol1_,b=a*b_a,eqEQ_),a=0..1); end proc;N:=20:b_a_:=seq(i/N,i=1..2*N):a__:=seq(a_(i/N),i=1..2*N):pl1:=[seq([b_a_[i],subs(sol1_,b=a*b_a_[i],a=a__[i],x[Comp[5]])],i=1..2*N)]:pl2:=[seq([b_a_[i],subs(sol1_,b=a*b_a_[i],a=a__[i],x[Comp[7]])],i=1..2*N)]:pl3:=[seq([b_a_[i],subs(sol1_,b=a*b_a_[i],a=a__[i],x[Comp[8]])],i=1..2*N)]:pl4:=[seq([b_a_[i],subs(sol1_,b=a*b_a_[i],a=a__[i],x[Comp[10]])],i=1..2*N)]:plot([pl1,pl2,pl3,pl4],b_a=0..2,x=0..1,color=black); |
 |
d) Calcular el incremento de poder calorífico de los gases de salida respecto a los de entrada para el caso anterior.
| > | eqDat:=a=b;b_:=fsolve(subs(sol1_,eqDat,eqEQ_),b):eqDat_:=subs(b=b_,eqDat):sol1__:=subs(b=b_,eqDat_,sol1_):eqM1:=subs(sol1_,eqDat_,b=b_,eqMIX(a*CH4+b*H2O=[5,7,8,10])/a):evalf(%,2);PCI_rect:=PCI(eqM1):PCI_rectificador=evalf(%,2);eq2:=CH4+2*O2=CO2+2*H2O:%;PCI_CH4:=PCI(eq2);eq3:=H2+(1/2)*O2=H2O:%;PCI_H2:=PCI(eq3):'PCI_H2'=evalf(%,3);eq4:=CO+(1/2)*O2=CO2:%;PCI_CO:=PCI(eq4):'PCI_CO'=evalf(%,3);PCIexhaust:='(x[H2]*PCI_H2+x[CO]*PCI_CO+x[CH4]*PCI_CH4)/a';PCIexhaust_:=subs(eqDat_,sol1__,%):'PCIexhaust'=evalf(%,3);'PCIexhaust'=evalf(subs(eqDat_,sol1__,(x[H2]*'PCI_H2'+x[CO]*'PCI_CO'+x[CH4]*'PCI_CH4')/a),3); |
Es decir, 1 mol de CH4 tenía 802 kJ de PCI, mientras que los gases generados por 1 mol de metano, 1,8H2+0,6CO+0,4CH4, tienen 930 kJ, y 930 kJ > 802 kJ.
Nótese que la rectificación es endotérmica, consumiéndose 130 kJ por mol de metano rectificador.
| > |