| > | restart:#"m15_p84" |
| > | read`../therm_eq.m`:read`../therm_chem.m`:with(therm_chem);with(therm_proc): |
Se quiere capturar el CO2 que se forma en la combustión de 1 m3/s de gas natural con aire, mediante el siguiente proceso de combustión en reactores separados. El combustible gaseoso (supóngase metano puro) entra en un reactor (RC) donde se oxida con un sólido portador de oxígeno, que en este caso es óxido de hierro-III, Fe2O3, en un lecho fluidizado (polvo en suspensión). Por otra parte, el aire entra en otro reactor (RA) donde oxida y regenera al portador de oxígeno (i.e. en otro lecho fluidizado, el aire oxida el polvo de Fe a Fe2O3). Las partículas sólidas se hacen recircular entre los dos reactores, todo en régimen estacionario. Se pide:
a) Estequiometria del proceso en el reactor RC, y masa de CO2 generada.
b) Gasto mínimo de aire necesario en el reactor RA.
c) Calcular la entalpía y la función de Gibbs, de la reacción en el reactor RC en condiciones estándar, interpretando el signo obtenido indicando si conviene trabajar a alta presión y/o alta temperatura.
d) Lo mismo, pero para el RA.
e) Comparación de este proceso con el de combustión directa de metano y aire.
Datos:
| > | su0:="Aire":su1:="CH4":su2:="H2O":su3:="CO2":fuel:=convert(su1,symbol);dat:=[V=1*m_^3/s,T0=(25+273)*K_]; |
| > | dat:=op(subs(g=g0,[Const])),op(dat),SI2,SI1:Adat:=get_gas_data(su0):Fdat:=get_gas_data(su1):Cdat:=get_gas_data(su3):get_pv_data(su2): |
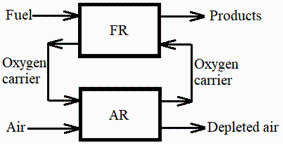
a) Estequiometria del proceso en el reactor RC, y masa de CO2 generada.
Supondremos que la entrada es a 25 ºC y 100 kPa.
| > | eqMGI:=rho=p/(R*T);p=subs(dat,p0);T=subs(dat,T0);eqMGI_:=subs(p=p0,T=T0,Fdat,dat,eqMGI);mF=rho*V;mF_:=subs(dat,eqMGI_,rho*V);eqGlobal:=fuel+A*(c21*O2+c79*N2)=cCO2*CO2+cH2O*H2O+cN2*N2;evalf(eq_fit(subs(dat,%)));eqRC:=CH4+(4/3)*F2O3=CO2+2*H2O+(8/3)*Fe;mCO2=mF*MC/MF;mCO2_:=subs(Fdat,MC=M,Cdat,mF_*MC/M); |
i.e. se consumen 0,67 kg/s de fuel y se generan 1,84 kg/s de CO2.
b) Gasto mínimo de aire necesario en el reactor RA.
| > | eqA0mol:=Ateo(fuel);eqA0mas:=A[0]=subs(Adat,MF=M,Fdat,rhs(eqA0mol*M/MF));mA=A[0]*mF;mA_:=rhs(eqA0mas)*mF_; |
i.e. se necesitan 11,5 kg/s de aire, como mínimo, para suministrar el O2 necesario.
c) Calcular la entalpía y la función de Gibbs, de la reacción en el reactor RC en condiciones estándar, interpretando el signo obtenido indicando si conviene trabajar a alta presión y/o alta temperatura.
| > | eqRC:=CH4+(4/3)*F2O3=CO2+2*H2O+(8/3)*Fe;hrRC:=h[f,CO2]+2*h[f,H2O]+(8/3)*h[f,Fe]-h[f,CH4]-(4/3)*h[f,Fe2O3];hgs_F:=get_hgs_data("CH4(g)");hgs_C:=get_hgs_data("CO2(g)");hgs_W:=get_hgs_data("H2O(l)");hgs_Fe2O3:=get_hgs_data("Fe2O3(s)");hgs_Fe:=get_hgs_data("Fe(s)");hrRC_:=hgs_C[1]+2*hgs_W[1]+(8/3)*hgs_Fe[1]-hgs_F[1]-(4/3)*hgs_Fe2O3[1];grRC_:=hgs_C[2]+2*hgs_W[2]+(8/3)*hgs_Fe[2]-hgs_F[2]-(4/3)*hgs_Fe2O3[2];srRC_:=hgs_C[3]+2*hgs_W[3]+(8/3)*hgs_Fe[3]-hgs_F[3]-(4/3)*hgs_Fe2O3[3]; |
i.e. en el RC, la reacción es endotérmica (hr>0) y se necesita un aporte de exergía (gr>0), pese a que la entropía aumenta (sr>0). Puede comprobarse que gr=hr-T25*sr. Para favorecer esta reacción conviene trabajar a alta temperatura y, como entonces el agua saldrá en estado gaseoso, trabajar a baja presión.
d) Lo mismo, pero para el RA.
| > | eqRA:=Fe+(3/4)*O2+(3/4)*N2*subs(dat,c79/c21)=Fe2O3+(3/4)*N2*subs(dat,c79/c21);hrRA=h[f,Fe2O3]-h[f,Fe]-(3/4)*h[f,O2];hgs_O:=get_hgs_data("O2(g)");hrRA_:=hgs_Fe2O3[1]-hgs_Fe[1]-(3/4)*hgs_O[1];grRA_:=hgs_Fe2O3[2]-hgs_Fe[2]-(3/4)*hgs_O[2];srRA_:=hgs_Fe2O3[3]-hgs_Fe[3]-(3/4)*hgs_O[3]; |
i.e. en el reactor RA, la reacción es exotérmica (hr<0) y espontánea (gr<0), disminuyendo la entropía (sr<0). Para favorecer esta reacción conviene trabajar a baja temperatura y alta presión.
e) Comparación de este proceso con el de combustión directa de metano y aire.
Globalmente resulta lo mismo, como se comprueba por combinación lineal (eq0=eqRC+(8/3)*eqRA), pero localmente es muy distinto:
-Ventaja: el CO2 se separa casi sin costes porque del RC sale una mezcla de CO2 y H2O que al enfriarla condensa el H2O y queda el CO2 casi puro.
-Inconveniente: se necesitan portadores sólidos de oxígeno, que hay que separar de los gases de salida (e.g. con ciclones) y recircularlos, sin que se vayan deteriorando con el tiempo de uso.
Para el transporte de oxígeno, en lugar de un metal como el Fe o el Ni, puede usarse un mineral como el yeso anhidro (e.g. CH4+CaSO4=CaS+CO2+2H2O). Este ejercicio está inspirado en Ajiwibowo et al. 2019.
| > |