| > | restart:#"m15_p59" |
| > | read`../therm_eq.m`:read`../therm_chem.m`:with(therm_chem);with(therm_proc): |
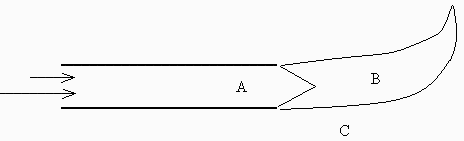
En un experimento de laboratorio, un tubo horizontal de plástico transparente de 25 mm de diámetro y 5 m de longitud se alimenta por un extremo con una mezcla de 0,510-3 m3/s de aire y 0,0310-3 m3/s de butano, ambos medidos a presión y temperatura ambiente de 94 kPa y 20 ºC. Se pide:
a) Velocidad de salida y riqueza de la mezcla.
b) Productos esperados en la combustión de premezcla, y su concentración.
c) Temperatura de la llama de premezcla y potencia térmica total.
Datos:
| > | su0:="Aire":su1:="C4H10":dat:=[D=0.025*m_,L=5*m_,Va=0.5e-3*m_^3/s_,Vf=0.03e-3*m_^3/s_,p0=94e3*Pa_,T0=(20+273)*K_]:dat:=[op(dat),A=evalf(subs(dat,Pi*D^2/4))]; |
Eqs. const.:
| > | dat:=op(subs(g=g0,[Const])),op(dat),SI2,SI1:Adat:=get_gas_data(su0):Fdat:=get_gas_data(su1): |
a) Velocidad de salida y riqueza de la mezcla.
| > | eqm:=Vdot=v*A;vsal:=(Va+Vf)/A;vsal_:=subs(dat,%);eq15_2;eqA0:=Ateo(su1);eqA:=A=Va/Vf;A_:=subs(dat,rhs(%));eq15_3;eqphi:=phi=rhs(eqA0)/A_;percent_f:=Vf/(Va+Vf);percent_f_:=subs(dat,%); |
i.e., sale a 1,1 m/s (típica de los quemadores de hidrocarburos) y la riqueza es de 1,9 (casi el doble del combustible teórico).
Regiones inflamables. Como en el tubo hay un 5,6% molar de gas, y mirando en la Tabla de propiedades de combustibles se ve que el n-butano es inflamable entre 1,5% y 9.3%, se concluye que sí, que dentro del tubo, si se produce una chispa, empezará a arder, y lo mismo en la región B mientras no se diluya mucho el chorro, mientras que por fuera, en la región C, no puede haber ignición. Si se inflama en B pero lejos, aunque sí se encendería, ya no se anclaría al borde sino que sería arrastrada por la corriente y desaparecería por exceso de aire.
Tipo de llama. Si se inflama dentro del tubo, como los gases se están moviendo a 1,1 m/s y la llama como máximo se desplazaría a 0,45 m/s (Tabla), la llama sería barrida fuera del tubo hasta apagarse por exceso de aire. Si se inflamase justo a la salida, la llama quedaría anclada al borde del tubo, formándose una llama de premezcla cónica de poca altura, estabilidaza por la llama secundaria de difusión, de mucha mayor longitud. La llama de premezcla sería azul-violeta y de poca intensidad, mientras que la de difusión sería marilla-naranja muy luminosa.
b) Productos esperados en la combustión de premezcla, y su concentración.
Como hay exceso de fuel, no se podrán oxidar todos los C y H a CO2 y H2O, saliendo bastante CO y algo de H2, y menos de CH4, y otros compuestod volátiles orgánicos.
Como es mucho el fuel sobrante, empezaremos ya suponiendo que sale CO y H2, y luego estimaremos el CH4.
Como hay que usar una ecuación de equilibrio químico, la solución dependerá de la temperatura, que se determinaría por el balance energético. Por simplicidad, supondremos una T de salida (que será menor que la de combustión adiabática teórica (2250 K), y luego iteraremos.
| > | eqMIX_:=eqMIX(a*C4H10+a*A*(c21*O2+c79*N2)=[3,4,6,7,8]);eqTad:=Tad=2000*K_;eqEQ_:=evalf(subs(T=Tad,eqTad,eqEQ(CO+H2O=CO2+H2)));sol1_:=allvalues(subs(dat,solve(subs(A=A_,{eqBC,eqBH,eqBO,eqBN,eqNX,eqEQ_}),{a,x[N2],x[CO2],x[H2O],x[CO],x[H2]})))[2];xCH4_:=solve(subs(T=1500*K_,p=p0,sol1_,eqEQ(CO+3*H2=CH4+H2O)),x[CH4]); |
Efectivamente, sale mucho sin quemar: sale 17% de CO y 12% de H2.
c) Temperatura de la llama de premezcla y potencia térmica total.
| > | eq15_7_2;eq15_5;PCI_:=subs(sol1_,PCI(eqMIX_)/a);eqTa_:=subs(sol1_,cpComp_,Const,eqTa);Q:=mf*PCI;mf:=Vf*p0/(R*T0);mf_:=subs(Fdat,dat,%);Q_:=subs(dat,mf_*PCI_/subs(Fdat,M)); |
![Ta = `+`(T25, `/`(`*`(a, `*`(PCI)), `*`(Sum(`*`(x[Com[i]], `*`(c[p, i])), i = 1 .. CP))))](images/p59_20.gif) |
i.e., la llama de premezcla alcanzaría 1600 K en vez de los 2000 K previstos, y entre las dos llamas disiparían 1300 W al ambiente. Iterando para mejorar la aproximación de la Tad:
| > | eqTad:=Tad=rhs(eqTa_);eqEQ_:=evalf(subs(T=Tad,eqTad,eqEQ(CO+H2O=CO2+H2)));sol1_:=allvalues(subs(dat,solve(subs(A=A_,{eqBC,eqBH,eqBO,eqBN,eqNX,eqEQ_}),{a,x[N2],x[CO2],x[H2O],x[CO],x[H2]})))[2];xCH4_:=solve(subs(T=1500*K_,p=p0,sol1_,eqEQ(CO+3*H2=CH4+H2O)),x[CH4]);PCI_:=subs(sol1_,PCI(eqMIX_)/a);eqTa_:=subs(sol1_,cpComp_,Const,eqTa);Q:=mf*PCI;mf:=Vf*p0/(R*T0);mf_:=subs(Fdat,dat,%);Q_:=subs(dat,mf_*PCI_/subs(Fdat,M)); |
Sí; unos 1600 K, luego, era suficiente la aproximación inicial.
| > |