| > | restart:#"m09_p53" |
| > | read`../therm_chem.m`:with(therm_chem);with(therm_proc):interface(displayprecision=2): |
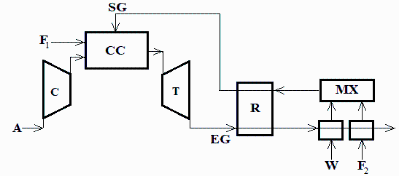
Se quiere estudiar la recuperación de calor de los gases de escape (EG) de una turbina, según se esquematiza en la figura. La turbina original toma aire ambiente (A) a 100 kPa y 15 ºC, lo comprime a 1 MPa, quema 1,1 kg/s de combustible (F1) en la cámara (CC), y los gases mueven la turbina (T) escapando al ambiente. La recuperación de calor de los gases de escape (EG) se haría reformando otro flujo de combustible (F2) con vapor procedente de agua de aporte W; el vapor se mezcla (MX) con el combustible secundario (F2) calentado, y la mezcla sufre el proceso de reformado en caliente (R) donde se genera un gas de síntesis (SG), el cual se añade en la cámara de combustión. Para este estudio se va a considerar que ambos combustibles (F1 y F2) son metanol puro. Se pide:
a) Calcular el aire estequiométrico, el poder calorífico superior, y la temperatura de combustión adiabática del metanol en condiciones estándar.
b) Sabiendo que la turbina original usa el cuádruple del aire teórico, calcular las temperaturas que se alcanzarían, y la potencia neta producida, suponiendo rendimientos isoentrópicos del 85%.
c) Suponiendo que el reformado se hace con mezcla equimolar de metanol y vapor, CH4O+H2O=CO2+3H2, determinar la entalpía estándar de la reacción, y la entropía y la función de Gibbs, interpretando los signos obtenidos.
d) Si el reformado tiene lugar a 500 ºC, calcular el poder calorífico de los gases de entrada y de salida, en su hipotética combustión con aire.
Datos:
| > | su1:="Aire":su2:="H2O":su3:="CH4O":dat:=[mf1=1.1*kg_/s_,p2=1e6*Pa_,lambda=4,eta=0.85,Tr=(500+273.15)*K_]; |
Eqs. const.:
| > | Adat:=get_gas_data(su1):Wdat:=get_gas_data(su2),get_liq_data(su2):Fdat:=get_gas_data(su3),get_liq_data(su3):pvF:=get_pv_data(su3):dat:=op(dat),op(subs(g=g0,[Const])),Adat,SI2,SI1:get_pv_data(su2): |
a) Calcular el aire estequiométrico, el poder calorífico superior, y la temperatura de combustión adiabática del metanol en condiciones estándar.
| > | eqA0mol:=Ateo(su3);eqA0mas:=lhs(%)=rhs(%)*subs(Adat,M)/subs(Fdat,M);eq0:=CH4O+(3/2)*O2=CO2+2*H2O;eq1:=CH4O+A0*(c21*O2+c79*N2)=a*CO2+b*H2O+c*N2;eq1_:=evalf(eq_fit(subs(A0=rhs(eqA0mol),dat,eq1)));eq15_5;PCSmol:=PCS(eq0);PCSmas:=PCSmol/subs(Fdat,M);eq15_7_2;PCImol:=PCI(eq0);PCImas:=PCImol/subs(Fdat,M);eqMIX(a*CH4O+subs(dat,a*A0*(c21*O2+c79*N2))=[2,3,4,6]);sol_:=solve(subs(A0=rhs(eqA0mol),dat,[eqNX,eqBC,eqBH,eqBO,eqBN]),[a,x[Comp[2]],x[Comp[3]],x[Comp[4]],x[Comp[6]]]);subs(op(sol_),cpComp,PCI_=PCImol,dat,eq15_7_3); |
![PC = `+`(`-`(Sum(`*`(nu[i], `*`(h[i])), i = 1 .. C)))](images/p53_9.gif) |
![Ta = `+`(T25, `/`(`*`(a, `*`(PCI)), `*`(Sum(`*`(x[Com[i]], `*`(c[p, i])), i = 1 .. CP))))](images/p53_12.gif) |
i.e. A0=7,1 molA/molF=6,5 kgA/kgF, PCS=726 kJ/molF=22,7 MJ/kgF, y la Ta=2180 K.
b) Sabiendo que la turbina original usa el cuádruple del aire teórico, calcular las temperaturas que se alcanzarían, y la potencia neta producida, suponiendo rendimientos isoentrópicos del 85%.
| > | eqC:=eq5_59;eqpi12:=pi[12]=p2/p1;eqpi12_:=subs(p1=p0,dat,%);T1_:=subs(dat,T0);gamma=subs(Adat,gamma);T2_:=subs(eqpi12_,T1=T1_,dat,solve(eqC,T2));eqT:=eq5_60;ma=lambda*A0mas*mf;mf1_:=subs(dat,mf1);ma_:=subs(A0mas=rhs(eqA0mas),dat,lambda*A0mas*mf1);eqBECC:=ma*c[p]*(T3-T2)=mf*PCI;T3_:=subs(dat,T2_+mf1_*PCImas/(ma_*c[p]));T4_:=subs(T3=T3_,p4=p0,p3=p2,dat,solve(eqT,T4));eqBE:=Wnet=ma*c[p]*(T3-T4-T2+T1);eqBE_:=subs(ma=ma_,T1=T0,T2=T2_,T3=T3_,T4=T4_,dat,%); |
![eta = `/`(`*`(`+`(`^`(pi[12], `/`(`*`(`+`(gamma, `-`(1))), `*`(gamma))), `-`(1))), `*`(`+`(`/`(`*`(T2), `*`(T1)), `-`(1))))](images/p53_18.gif) |
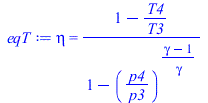 |
i.e. T1=T0=288 K, T2=603 K, T3=1370 K, T4=810 K, y el conjunto genera 7 MW.
c) Suponiendo que el reformado se hace con mezcla equimolar de metanol y vapor, CH4O+H2O=CO2+3H2, determinar la entalpía estándar de la reacción, y la entropía y la función de Gibbs, interpretando los signos obtenidos.
Las condiciones estándar son 25 ºC y 100 kPa (i.e. agua líquida), aunque en la práctica el reformado se va a hacer a unos 500 ºC (=773 K) con los gases de escape anteriores, a 810 K.
| > | eq2:=CH4O+H2O=CO2+3*H2;hr_gr_sr:=hgs_r25(eq2) |
i.e. la reacción es endotérmica (hr=131 kJ/molF>0), no es espontánea (gr=9 kJ/molF>0), y aumenta la entropía (sr=0,4 kJ/(mol·K)>0); esto último era evidente porque en condiciones estándar son dos moles de líquido los que se convierten en 4 moles de gas.
d) Si el reformado tiene lugar a 500 ºC, calcular el poder calorífico de los gases de entrada y de salida, en su combustión con aire.
Obviamente a esa temperatura todos son gases. Además, habrá que tener en cuenta la variación de la entalpía de reacción con la temperatura, por el gran aumento de cantidad de sustancia en la reacción (se duplican los moles).
| > | hr_25v:=h4_+3*h8_-h25_-h6_;dhr/dT=Sum(nu[i]*c[p,i],i=1..C);dhr_dT:=cpComp[4]+3*cpComp[8]-cpComp[25]-cpComp[6];hr_500:='hr_25v'+(T500-T2)*dhr/dT;hr_500_:=hr_25v+subs(dat,rhs(dhr_dT)*(Tr-T25)); |
![`/`(`*`(dhr), `*`(dT)) = Sum(`*`(nu[i], `*`(c[p, i])), i = 1 .. C)](images/p53_36.gif) |
i.e. en el reformador se han absorbido hr_500=80 kJ/molF. Ahora, la combustión con aire de los gases de salida de R y de entrada a R, daría:
| > | eq3:=CO2+3*H2+(3/2)*O2=CO2+3*H2O;PCI_R_out:=PCI(%);PCI_R_out_:=%/subs(Fdat,M);eq4:=CH4O+H2O+(3/2)*O2=CO2+3*H2O;PCI_R_in:=PCI(%);PCI_R_in_:=%/subs(Fdat,M);eqDelta:='PCI_R_out-PCI_R_in'=PCI_R_out-PCI_R_in; |
i.e. los gases de entrada al reformador tenían un PCI=638 kJ/molF, y a la salida tienen PCI=725 kJ/molF (nótese que todo se refiere por mol de metanol reformado). La diferencia entre ambos es la entalpía de reacción del reformador antes calculada, 80 kJ/molF, aunque aquí nos da algo mayor, 87 kJ/mol) porque no hemos tenido en cuenta aquí la variación del PCI con la temperatura, que, aunque despreciable frente al PCI, ya es significativa en la diferencia.
En resumen, los gases de escape de las turbinas de gas están muy calientes y convendría aprovecharlos, como se hace en el ciclo Brayton recuperativo, o con un ciclo combinado Brayton/Rankine, o como se propone aquí reformando el combustible. En este último caso hemos visto que se aumenta el poder calorífico del combustible; e.g. el PCI del metanol es de 19,9 MJ/kg, y el del reformado 22,7 MJ/kg, un aumentoconsiderable (el 14 %).
(Este ejercicio está inspirado en el trabajo de Pashchenko et al (2019).
| > |