| > | restart:#"m09_p38" |
| > | read`../therm_chem.m`:with(therm_chem);with(therm_proc): |
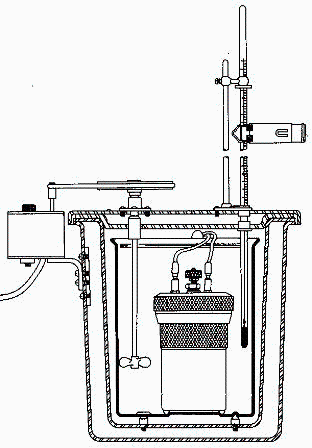
En una bomba calorimĂ©trica de 0,3 L de capacidad se dispone una muestra de 1 g de glucosa (C6H12O6), se tapa, se inyecta lentamente oxĂgeno puro hasta una presiĂłn manomĂ©trica de 3 MPa, y se produce la igniciĂłn con una diminuta resistencia elĂ©ctrica. Sabiendo que el ambiente está a 25 ÂşC y 90 kPa, se pide:
a) RelaciĂłn oxĂgeno/combustible usada, y comparaciĂłn con la estequiomĂ©trica.
b) Poder calorĂfico másico (superior e inferior) del combustible usado.
c) Temperatura de combustión adiabática.
d) Temperatura que alcanzarĂa el cuerpo de la bomba, de 2,5 kg de acero inoxidable, si no hubiese agua exterior (i.e. si sĂłlo se atemperaran adiabáticamente los gases con el cuerpo de la bomba).
Datos:
| > | su1:="O2":su2:="N2":su3:="H2O":su4:="Acero_inox":fuel:=C6H12O6:dat:=[V=0.3e-3*m_^3,mf=1e-3*kg_,p1=3.09e6*Pa_,T1=(25+273.15)*K_,p0=90e3*Pa_,T0=(25+273.15)*K_,mB=2.5*kg_]; |
Eqs. const.:
| > | dat:=op(dat),op(subs(g=g0,[Const])),SI2,SI1:Odat:=get_gas_data(su1):Ndat:=get_gas_data(su2):Wdat:=get_liq_data(su3):Bdat:=get_sol_data(su4):c_acero:=subs(%,c);Mf:=rhs(Mf(fuel));get_pv_data(su3): |
a) RelaciĂłn oxĂgeno/combustible usada, y comparaciĂłn con la estequiomĂ©trica.
La cantidad de N2 que queda atrapada será muy pequeña, pero vamos a calcularla:
| > | nN:=c79*p0*V/(R[u]*T0);nN_:=subs(dat,nN);mN:=nN*MN;mN_:=subs(Ndat,nN_*M)*1e3*g_/kg_;nO:=p1*V/(R[u]*T1);nO_:=subs(dat,nO);mO_:=subs(Odat,nO_*M)*1e3*g_/kg_;nf:='mf/Mf';nf_:=subs(dat,mf/Mf);Rox_f:='nO/nf';Rox_f_:=nO_/nf_;eqST:=eq_fit(fuel+a*O2=b*CO2+c*H2O);;Rox_fstq:=6;Rox_f_Rox_fstq:=Rox_f_/Rox_fstq; |
i.e. hay 0,0086 mol de N2 (0,24 g) y se introducen 0,38 mol de O2 (12 g). La relación Oxi/Fuel es Rox_f=67 mol/mol, que es 11 veces la estequiométrica (Rox_fstq=6 mol/mol)
b) Poder calorĂfico másico (superior e inferior) del combustible usado.
Calcularemos los PC a p=cte aunque en este caso se realice la combustión a V=cte; la diferencia es siempre pequeña (PC_V=PC_p+Sum(nui)*Ru*T25) y aquà nula por ser Sum(nui)=6-6=0.
| > | eq15_5;PCS_:=PCS(eqST);PCSm_:=PCS_/Mf;;PCI_:=PCI(eqST);PCIm_:=PCI_/Mf;; |
i.e. el superior es 15,6 MJ/kg (2,8 MJmol), y el inferior 14,1 MJ/kg (2,54 MJ/mol).
c) Temperatura de combustión adiabática
| > | eqTa_p:=eq15_7_2;eqMix_:=eqMIX(a*(fuel+Rox_f_*O2)=[2,4,5]);sol1_:=fsolve({eqNX,eqBC,eqBH,eqBO,eqBN},{a,x[Comp[2]],x[Comp[3]],x[Comp[4]],x[Comp[5]]});eqTa_p:=subs(sol1_,cpComp,dat,eq15_7_3);eqTa_V:=subs(c[p,i]=c[V,i],eq15_7_2);eqTa_V:=Ta=subs(cpComp,sol1_,Const,dat,T25+a*PCI_/(sum(delta[i]*x[Comp[i]]*(c[p,Comp[i]]-R[u]),i=1..C_))); |
![Ta = `+`(T25, `/`(`*`(a, `*`(PCI)), `*`(Sum(`*`(x[Com[i]], `*`(c[p, i])), i = 1 .. CP))))](images/p38_26.gif) |
![Ta = `+`(T25, `/`(`*`(a, `*`(PCI)), `*`(Sum(`*`(x[Com[i]], `*`(c[V, i])), i = 1 .. CP))))](images/p38_30.gif) |
i.e. en la combustiĂłn (a V=cte) se alcanzarĂan 1520 K (algo menos porque se disociarĂa parte del CO2 a CO y O2, y por la transmisiĂłn de calor a las paredes durante el proceso). Luego se atemperarĂa con el entorno.
d) Temperatura que alcanzarĂa el cuerpo de la bomba, de 2,5 kg de acero inoxidable, si no hubiese agua exterior (i.e. si sĂłlo se atemperaran adiabáticamente los gases con el cuerpo de la bomba).
Despreciando la capacidad térmica del interior, y dependiendo del agua que condense:
| > | Q:=mf*PCSm;eqBE:=mB*cB*(TBf-T25)=Q;Q_:=subs(dat,mf*PCSm_);TBf_:=subs(cB=c_acero,dat,T25+Q_/(mB*cB));'TBf'=TKC(%);Q:=mf*PCIm;eqBE:=mB*cB*(TBf-T25)=Q;Q_:=subs(dat,mf*PCIm_);TBf_:=subs(cB=c_acero,dat,T25+Q_/(mB*cB));'TBf'=TKC(%); |
i.e. el acero (y el interior) quedarĂas a 37 ÂşC si condensara toda el agua, o a 36 ÂşC si no condensara nada.
| > | 'nf'=nf_;'nO'=nO_;eqMIX(a*(nf_/mol_*fuel+nO_/mol_*O2)=[2,4,5]);sol_:=evalf(solve({eqBC,eqBH,eqBO,eqNX},{a,x[O2],x[CO2],x[H2O]}));eqSat:='x[H2O]=pv(T)/p1';Tdew_:=solve(subs(sol_,dat,x[H2O]=pv(T)/p1),T);'Tdew_'=TKC(%); |
i.e. sĂ que condensa casi toda el agua (empezarĂa a condensar a 128 ÂşC), por lo que se llegarĂa a 37 ÂşC.
En la práctica el acero no está aislado sino en contacto con una masa de agua, que es donde se mide el calentamiento y de ahĂ se deduce el poder calorĂfico del combustible.
| > |