| > | restart:#"m09_p33" |
Se desea realizar la combustión de un mol de hidrógeno con un mol de oxígeno puro, inicialmente a presión y temperatura ambiente, en un depósito eséfrico de acero. Se pide
a) Volumen del recipiente..
b) Estado termodinámico final tras el atemperamiento.
Datos:
| > | read`../therm_chem.m`:with(therm_chem);with(therm_proc): |
| > | su1:="H2":su2:="O2":su3:="H2O":dat:=[nHini=1*mol_,nOini=1*mol_,T0=(25+273)*K_]; |
Esquema:
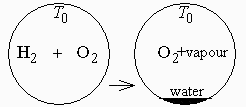
| > | Fdat:=get_gas_data(su1):Odat:=get_gas_data(su2):Wdat:=get_gas_data(su3),get_liq_data(su3):dat:=op(dat),op(subs(g=g0,[Const])),SI2,SI1:get_pv_data(su3):eq_esteq:=H2+(1/2)*O2=H2O;eq_mezcla:=H2+O2=H2O+(1/2)*O2; |
a) Volumen del recipiente.
| > | V:=n*R[u]*T/p;V:=(nHini+nOini)*R[u]*T0/p0;V_:=subs(dat,%); |
b) Estado termodinámico final tras el atemperamiento.
La T será la misma, T0, pero la presión bajará porque hay menos moles (1+1 dan 1+1/2) y, sobre todo, porque habrá condensado parte del agua, pues el oxígeno restante sólo será capaz de retener una fracción másica de vapor, xv,sat, dada por la ley de Raoult:
| > | eqRaoult:=x[v,sat]=p[v,T0]/p0;eqRaoult:=nvsat/(nOfin+nvsat)=evalf(subs(dat,pv(T0)/p0));eqMezcla1:=nOfin=(1/2)*mol_;eqMezcla2:=nw+nvsat=1*mol_;nvsat_:=solve(subs(eqMezcla1,eqRaoult),nvsat);nw_:=solve(subs(nvsat=nvsat_,eqMezcla2),nw);eqp:=p=n*R[u]*T/'V';eqp:=(nOfin+nvsat)*R[u]*T0/'V';eqp:=subs(eqMezcla1,nvsat=nvsat_,dat,%); |
i.e., la condensación genera un vacío y la presión absoluta es de apenas 26 kPa.
| > |