| > | restart:#"m09_p27" |
Considrese la combustin adiabática del hidrgeno; se desea estudiar el trabajo máximo obtenible de los gases de escape, y compararlo con la exerga del combustible. En particular, se pide:
a) Influencia del nitrgeno en el trabajo máximo obtenible en la combustin a p=cte.
b) Influencia del nitrgeno en el trabajo máximo obtenible en la combustin a V=cte.
Datos:
| > | read`../therm_chem.m`:with(therm_chem);with(therm_proc): |
| > | su1:="Aire":su2:="H2O":fuel:=H2;fuel_:=convert(fuel,string):dat:=[T0=298*K_,x[N2]=0.756,x[O2]=0.2034,x[H2O]=0.0312,x[Ar]=0.0091,x[CO2]=0.0003];dat15_60:=[T0=288*K_,x[N2]=0.772,x[O2]=0.208,x[H2O]=0.0102,x[Ar]=0.0095,x[CO2]=0.0003]; |
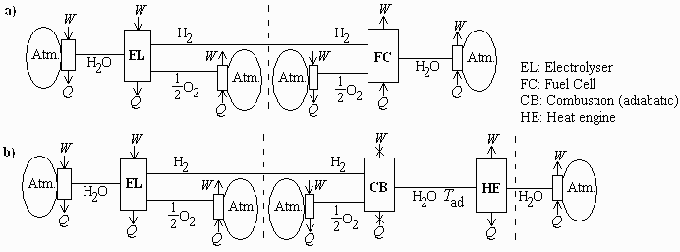
Fig. 1. Esquema de procesos reversibles (a) y de combustin adiabática (b).
Eqs. const.:
| > | Adat:=get_gas_data(su1):gdat:=get_gas_data(fuel_):ldat:=get_liq_data(fuel_):dat:=op(dat),op(subs(g=g0,[Const])),gdat,ldat,SI2,SI1:Mf(fuel);get_pv_data(su2):eq:=H2+(1/2)*O2=H2O; |
a) Influencia del nitrgeno en el trabajo máximo obtenible en la combustin a p=cte.
Primero determinamos la exerga del H2 a 25 C y 100 kPa, i.e. el Wmin para obtenerlo de la atmsfera de referencia (hasta la lnea de trazos en la Fig. 1a):
| > | phi[fuel]:=phi[sep,prod]+phi[react,inv]+phi[mix,oxy];phi[H2,std]:=phi[H2O,std]+phi[r25,H2O=H2+(1/2)*O2]-phi[O2,std]/2;phi[H2O,std]:=-R[u]*T0*ln(x[H2O]*p0/p[v](T0));phi[H2O,std_]:=subs(dat,evalf(subs(dat,-R[u]*T0*ln(x[H2O]*p0/pv(T0))))):'phi[H2O,std]'=evalf(%,2);phi[r25_,H2O=H2+(1/2)*O2]:=-hgs_r25(eq)[2]:'phi[r25,H2O=H2+(1/2)*O2]'=evalf(%,3);;phi[O2,std_]:=subs(dat,evalf(subs(dat,-R[u]*T0*ln(x[O2])))):'phi[O2,std]'=evalf(%,2);phi[H2,std_]:=phi[H2O,std_]+phi[r25_,H2O=H2+(1/2)*O2]-phi[O2,std_]/2:'phi[H2,std]'=evalf(%,3); |
i.e. si slo se usa la atmsfera de referencia, generar hidrgeno costara como mnimo 235 kJ/mol (hasta la lnea a trazos en la Fig. 1a), y a partir de l se podra generar como máximo 235 kJ/mol de trabajo (desde la lnea a trazos en la Fig. 1a).
Ahora vamos con la combustin adiabática y el motor trmico ideal (entre las dos lneas de trazos de la Fig. 1b).
Si p=cte en AIRE a T25 y p0.
| > | eqMIX(a*H2+a*A*(c21*O2+c79*N2)=[3,6]);sol1_:=solve({eqNX,eqBC,eqBH,eqBO,eqBN},{a,A,x[N2],x[H2O]}):evalf(%,2);i:='i':PCI_:=PCI(eq):'PCI'=evalf(%,3);PCS_:=PCS(eq):'PCS'=evalf(%,3);Ta=T25+a*PCI/(x[N2]*c[p,N2]+x[H2O]*c[p,H2O]);Ta_:=subs(cpComp,sol1_,dat,rhs(eq15_7_3)):'Ta'=evalf(%,3);w:=Dphi;w:=Dh-T25*Ds;Dh:=PCS;Dh:=(x[N2]*c[p,N2]*(Ta-T25)+x[H2O]*c[p,H2O]*(Ta-T25)+x[H2O]*(44000*J_/mol_))/a;Dh_:=subs(dat,evalf(subs(cpComp,Ta=Ta_,sol1_,dat,Dh))):'Dh'=evalf(%,3);Ds:=(x[N2]*c[p,N2]*ln(Ta/T25)+x[H2O]*c[p,H2O]*ln(Ta/T25)+x[H2O]*(44000*J_/mol_)/T25)/a;Ds_:=subs(dat,evalf(subs(cpComp,Ta=Ta_,sol1_,dat,Ds))):'Ds'=evalf(%,2);w_:=subs(dat,Dh_-T25*Ds_):'w'=evalf(%,2); |
i.e., por cada mol de H2 se calientan 2,9 moles hasta 2480 K, quedando con una exerga termomecánica de 170 kJ por mol de H2. La entropa generada en la combustin adiabática por mol de H2 es:
| > | s[gen]:='Ds+q/T';s[gen]:='Ds[Quim]+Ds[Term]';Ds[Quim]:=s[r25];Ds[Quim_]:=hgs_r25(eq)[3]:'Ds[Quim]'=evalf(%,2);Ds[Term_]:=Ds_:'Ds[Term]'=evalf(%,2);s[gen_]:=Ds[Quim_]+Ds[Term_]:'s[gen]'=evalf(%,2); |
(ntese que la entropa de reaccin en negativa porque salen menos moles y encima condensan) mientras que en una pila de combustible ideal no se generara entropa en el proceso:
| > | s[gen_FC]:='s[r25]+q/T25';q:='PCS-w';w:=-gr25;hgs:=hgs_r25(eq);s[gen_FC_]:=subs(s[r25]=hgs[3],PCS=PCS_,gr25=hgs[2],dat,s[gen_FC]):'s[gen_FC]'=evalf(%,1); |
Si p=cte en O2 a T25 y p0. Suponiendo que no se disociara!
| > | q:='q':eqMIX(a*H2+a*A*O2=[3,6]);sol1_:=solve({eqNX,eqBC,eqBH,eqBO,eqBN},{a,A,x[N2],x[H2O]});Ta_:=subs(cpComp,sol1_,dat,rhs(eq15_7_3)):'Ta'=evalf(%,3);w:=Dphi;w:='Dh-T25*Ds';Dh:=PCS;Dh:=(c[p,H2O]*(Ta-T25)+(44000*J_/mol_))/a;Dh_:=subs(dat,evalf(subs(cpComp,Ta=Ta_,sol1_,dat,Dh))):'Dh'=evalf(%,3);Ds:=(c[p,H2O]*ln(Ta/T25)+(44000*J_/mol_)/T25)/a;Ds_:=subs(dat,evalf(subs(cpComp,Ta=Ta_,sol1_,dat,Ds))):'Ds'=evalf(%,2);w_:=subs(dat,Dh_-T25*Ds_):'w'=evalf(%,2);s[gen]:='Ds+q/T';s[gen]:='Ds[Quim]+Ds[Term]';Ds[Quim]:=s[r25];Ds[Quim_]:=hgs_r25(eq)[3]:'Ds[Quim]'=evalf(%,2);Ds[Term_]:=Ds_:'Ds[Term]'=evalf(%,2);s[gen_]:=Ds[Quim_]+Ds[Term_]:'s[gen]'=evalf(%,2); |
i.e., por cada mol de H2 se calentara un mol (de vapor) hasta 5400 K, quedando con una exerga termomecánica de 200 kJ (por mol de H2), bastante mayor que los 170 kJ/mol de la combustin adiabática con aire (en realidad habra que minorar esos 200 kJ/mol en 2 kJ/mol, mnimo necesario para obtener el oxgeno puro). La entropa generada en la combustin adiabática por mol de H2 es menor que antes.
Conclusin: no conviene diluir los gases de combustin con un inerte; conviene alcanzar la máxima temperatura posible (como ya ense Carnot en 1824). Pero en la práctica se usa el aire y no el O2 puro, e incluso se diluye todava más con gran exceso de aire en motores diesel y turbinas de gas por problemas de materiales.
Ntese que incluso estos 200 kJ/mol no llegan a los 237 kJ/mol (-gr25) que podra dar una pila de combustible ideal en un proceso isobárico isotermo.
Ntese tambin que si se realiza la combustin a p=cte y T=cte=T25 (proceso isobárico isotermo, e.g. aadiendo un enorme exceso de aire), toda la exerga se pierde, Dphi=237000=T25*sgen25=298*800= T25*(sr25+PCS/T25).
| > |
ENGLISH:
The entropy change due to reaction at std-state is sr=-163 J/(mol.K), decreases because 1.5 moles of gases yield 1 mol of liquid.
The entropy generation in the adiabatic isobaric combustion is sr+Ds=220 J/(mol.K). After that, the maximum work available is 170 kJ/mol (against the limit of 237 kJ/mol for H2).
The entropy generation in the isothermal isobaric combustion is sr for the system and PCS/T0 for the environment, sr+PCS/T25=800 J/(mol.K), the whole exergy is lost: Dpsi=T0*sgen=237e3 J/mol=298*800 J/mol.
The entropy generation in the isothermal isobaric ideal fuel cell is 0.
Note the effect of nitrogen: with pure oxygen, the entropy generation in the adiabatic isobaric combustion is only sr+Ds=120 J/(mol.K). The more inert gas is added, the more entropy is generated (adding infinite nitrogen would lower the adiabatic temperature to T25 and 800 J/(mol.K) would be generated. The maximum work from H2 in a fuell cell is 237 kJ/mol, whereas after adiabatic combustion with pure oxygen is 200 kJ/mol and with air is 170 kJ/mol.
ENGLISH END.
Si V=cte en AIRE a T25 y p0. Primero calculamos PCS_V y luego la Tad.
| > | eqMIX(a*H2+a*A*(c21*O2+c79*N2)=[3,6]);sol1_:=solve({eqNX,eqBC,eqBH,eqBO,eqBN},{a,A,x[N2],x[H2O]}):evalf(%,2);PCS_V:=-ur25;PCS_V:=-hr25+(p1*V-p0*V)/nf;V:=nf*(1+A)*R[u]*T0/p0;V_nf0_:=subs(sol1_,dat,V/nf):'V_nf0'=evalf(%,2);PCI_V:='PCS_V-x[H2O]*h[lv25]/a';Ta='T25+a*PCI_V/(x[N2]*c[v,N2]+x[H2O]*c[v,H2O])'; |
i.e. en condiciones iniciales, 1 mol de H2, más el aire estequiomtrico, ocupan 84 litros.
Para determinar la Ta se necesita el PC, y para ello la presión tras la combustión a V=cte y T=25.
Suponiendo que tras la combustin toda el agua condensa, la presin final será la debida al N2.
| > | p1:='nN*R[u]*T0/V';nN_nf0:=x[N2]/a;p1:='nN_nf0*R[u]*T0/V_nf0';p1_:=subs(V_nf0=V_nf0_,sol1_,dat,p1):'p1'=evalf(%,2);PCS_V_:=subs(hr25=hgs[1],V_nf0=V_nf0_,sol1_,dat,PCS_V):'PCS_V'=evalf(%,3);PCI_V:='PCS_V_-x[H2O]*(44000*J_/mol_)/a';PCI_V_:=subs(sol1_,dat,PCI_V):'PCI_V'=evalf(%,3);Ta_:=subs(sol1_,cpComp,dat,T25+a*PCI_V_/(x[N2]*c[p,N2]+x[H2O]*c[p,H2O]-R[u])):'Ta'=evalf(%,2);pa:='(nN+Nw)*R[u]*Ta/V';pa:='R[u]*Ta/(V_nf0*a)';pa_:=subs(sol1_,dat,R[u]*Ta_/(V_nf0_*a)):'pa'=evalf(%,2); |
i.e. tras atemperarse quedaría a 56 kPa y se habrían evacuado PCS_V=282 kJ/mol (el PCS_p era 286 kJ/mol, menor porque al disminuir la cantidad de sustancia gaseosa la atmsfera aportaría esos 4 kJ/mol de diferencia al dejar que se igualasen las presiones).
Tras la combustión adiabática a V=cte con aire se alcanzan 3000 K (>2480 K a p=cte) y una presión de 870 kPa, y el trabajo máximo obtenible será la exergía necesaria para conseguir ese estado a partir de la atmósfera de referencia. Despreciando el trabajo químico, el termomecánico es el obtenible de la mezcla desde (Ta,pa) hasta (T25,p0) sin la restricción de V=cte, i.e., por mol de H2:
| > | w:=Dphi;w:=Du+p0*Dv-T25*Ds;Du:='PCS_V';Du_:=evalf(PCS_V_,3);Dv:='V_nf0-nN_nf0*R[u]*T0/p0';Dv_:=subs(sol1_,dat,V_nf0_-(x[N2]/a)*R[u]*T0/p0):'Dv'=evalf(%,2);Ds:='(x[N2]*(c[p,N2]*ln(Ta/T25)-R[u]*ln(pa/p0))+x[H2O]*((44000*J_/mol_)/T25+c[p,H2O]*ln(Ta/T25)-R[u]*ln(pa/p0)))/a';Ds_:=subs(dat,evalf(subs(V_nf0=V_nf0_,cpComp,sol1_,Ta=Ta_,dat,Ds))):'Ds'=evalf(%,2);w_:=subs(dat,Du_+p0*Dv_-T25*Ds_):'w'=evalf(%,3); |
i.e. tras la combustión adiabática a V=cte con aire se podrían extraer 180 kJ/mol (>170 kJ/mol a p=cte).
Si V=cte en O2 puro a T25 y p0.
La presión final a T25 será pvT25=3,17 kPa.
| > | eqMIX(a*H2+a*A*O2=[3,6]);sol1_:=solve({eqNX,eqBC,eqBH,eqBO,eqBN},{a,A,x[N2],x[H2O]}):evalf(%,2);p1:=p[v](T0);p1_:=subs(dat,evalf(subs(dat,pv(T0)))):'p1'=evalf(%,3);PCS_V_:=subs(dat,-hgs[1]+(p1_-p0)*V_nf0_);PCI_V:='PCS_V-h[lv25]/a';Ta:='T25+a*PCI_V/c[v,H2O]';Ta_:=subs(sol1_,cpComp,dat,T25+a*PCI_V_/(c[p,H2O]-R[u])):'Ta'=evalf(%,2);pa:='R[u]*Ta/(V_nf0*a)';pa_:=subs(sol1_,dat,R[u]*Ta_/(V_nf0_*a)):'pa'=evalf(%,2);w:='Dphi';w:='Du+p0*Dv-T25*Ds';Du:='PCS_V';Du_:=evalf(PCS_V_,3);Dv:='V_nf0-0';Dv_:=subs(sol1_,dat,V_nf0_-0):'Dv'=evalf(%,2);Ds:='(44000*J_/mol_)/T25+c[p,H2O]*ln(Ta/T25)-R[u]*ln(pa/p0)/a';Ds_:=subs(dat,evalf(subs(sol1_,cpComp,dat,(44000*J_/mol_)/T25+c[p,H2O]*ln(Ta_/T25)-R[u]*ln(pa_/p0)/a))):'Ds'=evalf(%,2);w_:=subs(dat,Du_+p0*Dv_-T25*Ds_):'w'=evalf(%,3); |
i.e. tras la combustión adiabática a V=cte con =2 puro se podrían extraer 204 kJ/mol (>200 kJ/mol a p=cte).
| > |