| > | restart:#"m09_p10" |
En un dispositivo cilindro émbolo que mantiene la presión constante existe inicialmente 1 mol de aire a 25 °C y 100 kPa. Se supone que existe una fuente de carbono (p.e. que las paredes son de grafito). Se pide:
a) ¿Es posible conocer la composición de los gases producidos por la combustión del carbono?
b) Suponiendo que en el proceso reactivo sólo se generase CO2, calcular la composición de equilibrio.
c) Suponiendo que se generan CO2 y CO, calcular la composición de equilibrio en el intervalo 500 < T < 2000 K para p = 100 kPa.
d) Calcular la composición de equilibrio para T = 1000 K en el intervalo 104 < p < 107 Pa
Datos:
| > | read`../therm_chem.m`:with(therm_chem):with(therm_proc):with(plots): |
| > | su1:="Aire":dat:=[T1=1000*K_,T2=500*K_,T3=2000*K_,p1=1e5*Pa_,p2=1e4*Pa_,p3=1e7*Pa_]; |
Eqs. const.:
| > | dat:=op(dat),op(subs(g=g0,[Const])),SI2,SI1: |
a) ¿Es posible conocer la composición de los gases producidos por la combustión del carbono?
No, sólo si se sabe qué especies aparecen, y aún así dependerá de la temperatura y la presión, pero si se supone combustión completa, entonces sí, porque la relación de mezcla (por unidad de cantidad de productos) sería:
| > | eqMIX(a*C+b*(c21*O2+c79*N2)=[3,4]);'eqNX'=eqNX;'eqBC'=eqBC;'eqBH'=eqBH;'eqBO'=eqBO;'eqBN'=eqBN;sol1:=solve({eqNX,eqBC,eqBH,eqBO,eqBN},{a,b,x[Comp[3]],x[Comp[4]]});sol1_:=subs(dat,sol1):'sol1'=evalf(%,2); |
b) Suponiendo que en el proceso reactivo sólo se generase CO2, calcular la composición de equilibrio.
Equilibrio entre el gas producido y los componentes iniciales.
| > | eq1:=C+O2=CO2;eq9_25;eqhr25:=hrR=hgs_r25(eq1)[1]:%;eqgr25:=grR=hgs_r25(eq1)[2]:%;lnK_:=subs(dat,expand(subs(eqhr25,eqgr25,dat,rhs(eq9_25))));eqEQ1:=evalf(subs(p=p0,dat,eqEQ(eq1)));eqEQ1_:=evalf(subs(T=T1,dat,eqEQ1));eqMIX(a*C+b*(c21*O2+c79*N2)=[2,3,4]);sol1:=solve({eqNX,eqBC,eqBH,eqBO,eqBN,eqEQ1_},{a,b,x[Comp[2]],x[Comp[3]],x[Comp[4]]}):sol1_:=subs(dat,sol1):'sol1'=evalf(%,2); |
que indica que para cualquier temperatura razonable (hasta T>50000 K) todo el O2 se gastaría, dando CO2.
c) Suponiendo que se generan CO2 y CO, calcular la composición de equilibrio en el intervalo 500 < T < 2000 K para p = 100 kPa.
Como vemos que si hay reacción del C con el O2 desaparece todo el O2 (reactivo limitante), conviene plantear una estequiometría en la que no participe el O2, i.e.:
| > | eq2:=C+CO2=2*CO;eq9_25;eqhr25:=hrR=hgs_r25(eq2)[1]:%;eqgr25:=grR=hgs_r25(eq2)[2]:%;lnK_:=subs(dat,expand(subs(eqhr25,eqgr25,dat,rhs(eq9_25))));eqEQ2:=evalf(subs(p=p0,dat,eqEQ(eq2)));eqMIX(a*C+b*(c21*O2+c79*N2)=[3,4,7]);sol1:=solve({eqNX,eqBC,eqBH,eqBO,eqBN},{a,b,x[Comp[3]],x[Comp[4]]});eqsol:=subs(sol1,dat,eqEQ2):sol2_:=x[CO]=solve(eqsol,x[CO])[1];sol2_Tinf:=evalf(subs(T=5000*K_,%));eqlnK0:=lnK_=0;T[trans]:=solve(lnK_=0,T);pl:=plot(evalf(subs(sol1,sol2_,dat,SI0,{x[Comp[3]],x[Comp[4]],x[Comp[7]]})),T=0..subs(dat,T3/K_),xs=0..1,color=black):pt:=textplot([[1000,0.1,"CO2"],[1000,0.35,"CO"],[1000,0.75,"N2"]]):display([pl,pt]); |
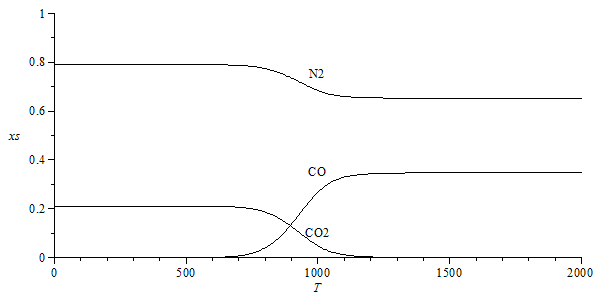 |
i.e., si reacciona el C con el O2, a baja temperatura (T<900 K) predomina la reacción C+O2=CO2, conviertiéndose el 21% de O2 en 21% de CO2 (y el resto N2). Sin embargo, por encima de 1000 K predomina la reacción C+(1/2)O2=CO; como cada mol de O2 da dos moles de CO, si inicialmente había 0,21 mol de O2, se formarán 0,42 mol de CO, que junto a los 0,79 mol iniciales de N2 da una xCO=0,42/(0,42+0,79)=0,35 (i.e. a alta T habrá 35% de CO y 65% de N2).
d) Calcular la composición de equilibrio para T = 1000 K en el intervalo 104 < p < 106 Pa
| > | eq2_:=evalf(subs(T=T1,dat,eqEQ(eq2)));eqMIX(a*C+b*(c21*O2+c79*N2)=[3,4,7]):sol1:=solve({eqNX,eqBC,eqBH,eqBO,eqBN},{a,b,x[Comp[3]],x[Comp[4]]}):eqsol:=subs(sol1,dat,eq2_):sol2_:=x[CO]=expand(subs(SI0,solve(eqsol,x[CO])[1]));evalf(subs(p=1e5*Pa_,%)):with(plots):pl:=semilogplot(evalf(subs(sol1,sol2_,dat,SI0,{x[Comp[3]],x[Comp[4]],x[Comp[7]]})),p=subs(dat,p2/Pa_)..subs(dat,p3/Pa_),xs=0..1,color=black):pt:=textplot([[1e5,0.1,"CO2"],[1e5,0.4,"CO"],[1e5,0.8,"N2"]]):display([pl,pt]); |
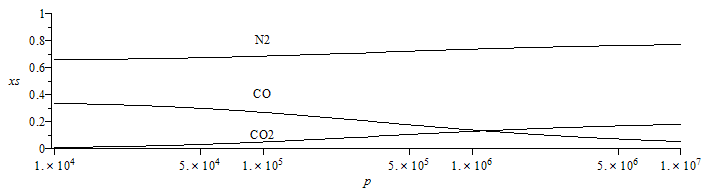 |
que muestra que al aumentar la presión se favorece la transición CO a CO2 porque disminuye la cantidad de sustancia (como enseña el principio de Le Chatelier)..
| > |