| > | estart:#"m08_p44" |
En un recipiente cerrado y rígido se tiene inicialmente un mol de hidrógeno, medio mol de oxígeno y 1,88 moles de nitrógeno, a presión y tempeatura ambiente. Se produce una chispa en su interior y tiene lugar la combustión, que se supone completa, quedando finalmente un mol de agua y 1,88 moles de nitrógeno a temperatura ambiente. Se pide determinar las fracciones másica y molar de hidrógeno en la mezcla inicial, el volumen del recipiente, y la presión final.
Datos:
| > | read`../therm_eq.m`:read`../therm_const.m`:read`../therm_proc.m`:with(therm_proc): |
| > | su1:="N2":su2:="H2O":su3:="H2":su4:="O2":dat:=[nH1=1*mol_,nO1=0.5*mol_,nN1=1.88*mol_,nw=1*mol_,nN=1.88*mol_]; |
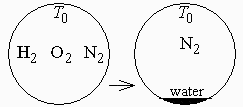
Esquema:
| > |
| > |
Eqs. const.:
| > | Adat:=get_gas_data(su1):Adat:=subs(c[p]=c[pa],R=R[a],M=M[a],T[b]=nada,[Adat]):Wgdat:=get_gas_data(su2):Wgdat:=subs(c[p]=c[pv],R=R[v],M=M[v],[Wgdat]):Wldat:=get_liq_data(su2):Wdat:=op(Wgdat),Wldat:get_pv_data(su2):Mva_:=subs(Adat,Wdat,M[v]/M[a]):'M[va]'=evalf(%,3);dat:=Mva=Mva_,op(dat),Const,SI2,SI1:Hdat:=get_gas_data(su3):Odat:=get_gas_data(su4): |
Antes de reaccionar:
| > | V:=n*R[u]*T0/p0;n1:=nH1+nO1+nN1;n1_:=subs(dat,%);V_:=subs(n=n1_,dat,V):'V'=evalf(%,2);xH1:=nH1/(nH1+nO1+nN1);vH1_:=subs(dat,xH1):'xH1'=evalf(%,2);yH1:=subs(Hdat,nH1*M)/(subs(Hdat,nH1*M)+subs(Odat,nO1*M)+subs(Adat,nN1*M[a]));yH1_:=subs(dat,yH1):'yH1'=evalf(%,2); |
Después de reaccionar y atemperarse es de suponer que condense parte del agua a esa temperatura. En primera aproximación condensa toda el agua y apenas ocupa volumen, quedando sólo el N2:
| > | nH1*H2+nO1*O2+nN1*N2=nw*H2O+nN*N2;expand(subs(dat,%/mol_));p2:=nN*R[u]*T0/V;p2_:=subs(dat,nN*R[u]*T0/V_):'p2'=evalf(%,2); |
i.e. el recipiente quedará casi a la mitad de la presión inicial. Mejorando el modelo, sea nw=nv+nl el reparto de H2O.
| > | eqV:='V'=(nv+nN)*R[u]*T0/p+nl*vl;eqV_:=V_=subs(dat,(nv+nN)*R[u]*T0/p):eqbif:=nv/(nv+nN)=p[v](T0)/p;p[v](T0):=subs(dat,evalf(subs(dat,pv(T0)))):'p[v](T0)'=evalf(%,2);sol1_:=subs(dat,solve(subs(dat,{eqV_,eqbif}),{nv,p})):p2_:=subs(sol1_,p):'p2'=evalf(%,2);nv_:=subs(sol1_,nv):'nv'=evalf(%,2);nl:=nw-nv;nl_:=subs(dat,nw-nv_):'nl'=evalf(%,2);ml_:=subs(Wdat,nl_*M[v]):'ml'=evalf(%,2);Vl_:=subs(Wdat,ml_/rho):'Vl'=evalf(%,2); |
i.e., no queda a 56 kPa sino a 57 kPa, y no condensa todo sino el 94%, que ocupa un volumen de líquido de 17 cm3, que se ha despreciado frente a los 81 litros del recipiente.
| > |