| > | restart:#"m07_p40" |
Dentro de un recipiente de 10 litros hay una mezcla de propano y n-butano a 400 kPa de presión manométrica en un ambiente a 20 ºC y 100 kPa. Se pide:
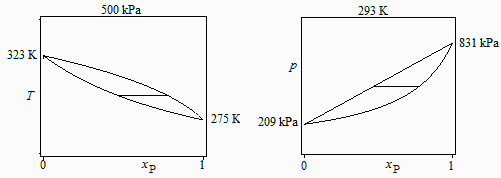
a) Diagramas esquemáticos T-x y p-x de todas las mezclas posibles a esa presión y esa temperatura, respectivamente, indicando los valores de los extremos (sustancias puras).
b) Intervalo de composiciones de los posibles estados de equilibrio bifásico en el interior.
c) ComposiciĂłn interior si la proporciĂłn propano/butano fuese equiponderal.
d) Masa interior.
Datos:
| > | read`../therm_eq.m`:read`../therm_const.m`:read`../therm_proc.m`:with(therm_proc):Digits:=5: |
| > | su1:="C3H8":su2:="C4H10":dat:=[V=0.010*m_^3,T0=(20+273.15)*K_,p1=(400+100)*1e3*Pa_,y01=1/2]; |
| > | g1dat:=get_gas_data(su1):l1dat:=get_liq_data(su1):g2dat:=get_gas_data(su2):l2dat:=get_liq_data(su2):dat1:=op(dat),g1dat,l1dat,Const,SI2,SI1:dat2:=op(dat),g2dat,l2dat,Const,SI2,SI1:pv1:=proc(T) global su1;get_pv_data(su1);RETURN(pv(T)):end:pv2:=proc(T) global su1;get_pv_data(su2);RETURN(pv(T)):end: |
| > | eqNV:=xv1+xv2=1;eqNL:=xl1+xl2=1;eqC1:=xv1*xv0+xl1*xl0=x01;eqC2:=xv2*xv0+xl2*xl0=x02;eqE1:=xv1/xl1=pv1/p;eqE2:=xv2/xl2=pv2/p;sol1:=solve({eqNV,eqNL,eqE1,eqE2},{xv1,xv2,xl1,xl2});sol2:=solve({eqC1,eqC2},{xv0,xl0}); |
a) Diagramas esquemáticos T-x y p-x de todas las mezclas posibles a esa presión y esa temperatura, indicando los valores de los extremos (sustancias puras).
| > | 'p1'=subs(dat,p1);Tv=T[v](pv);Tv1_:=solve(subs(dat,p1)=pv1(T),T);'Tv1_'=TKC(%);Tv2_:=solve(subs(dat,p1)=pv2(T),T);'Tv2_'=TKC(%);'T1'=subs(dat,T0);pv=p[v](T);pv1_:=evalf(subs(dat,pv1(T0)));pv2_:=evalf(subs(dat,pv2(T0))); |
Los valores extremos se deducen del equilibrio lĂquido-vapor de cada sustancia pura (Clapeyron o Antoine).:
-para propano puro a p1=500 kPa Tv1=2 ÂşC, para butano puro Tv2=50 ÂşC;
-para propano puro a 20 ÂşC pv1=830 kPa y para el butano pv2=210 kPa.
b) Intervalo de composiciones de los posibles estados de equilibrio bifásico en el interior.
Con el modelo de mezcla ideal:
| > | x1boil:='(p1-pv2(T))/(pv1(T)-pv2(T))';x1dew:='(1/p1-1/pv2(T))/(1/pv1(T)-1/pv2(T))';x1boil_:=evalf(subs(T=T0,dat,x1boil));x1dew_:=evalf(subs(T=T0,dat,x1dew));y1boil_:=x1boil_*subs(dat1,M)/(x1boil_*subs(dat1,M)+(1-x1boil_)*subs(dat2,M));y1dew_:=x1dew_*subs(dat1,M)/(x1dew_*subs(dat1,M)+(1-x1dew_)*subs(dat2,M)); |
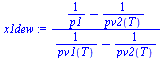 |
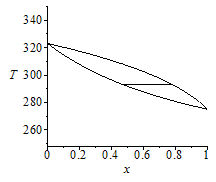
i.e. si la mezcla está a 20 ÂşC y 500 kPa, sĂłlo puede haber mezcla bifásica para fracciones molares de propano en el rango 0,47..0,78, correspondiente a fracciones másicas de propano en el rango 0,40..0,73 (si hubiera menos propano la mezcla serĂa lĂquida, y si hubise más serĂa una mezcla gaseosa).
Los diagramas T-x y p-x a escala serĂan:
| > | plot(subs(dat,SI0,{[[x1boil_,T0],[x1dew_,T0]],solve(x=x1boil,T),solve(x=x1dew,T)}),x=0..1,'T'=250..350,color=black);pboil:=x*pv1+(1-x)*pv2;pdew:=pv1/(x+(1-x)*pv1/pv2);plot(subs(pv1=pv1_,pv2=pv2_,dat,SI0,{[[x1boil_,p1],[x1dew_,p1]],pboil,pdew}),x=0..1,'p'=00..1e6,color=black); |
 |
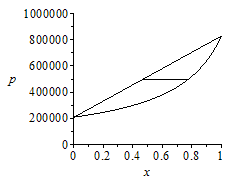 |
c) ComposiciĂłn interior si la proporciĂłn propano/butano fuese equiponderal.
| > | eqx01:=x01=y01/M1/(y01/M1+y02/M2);'y01'=subs(dat,y01);eqx01:=x01=subs(dat,y01/subs(dat1,M)/(y01/subs(dat1,M)+(1-y01)/subs(dat2,M)));sol1_:=subs(dat,evalf(subs(p=p1,pv1=pv1(T),pv2=pv2(T),T=T0,dat,sol1)));sol2_:=subs(sol1_,x02=1-x01,eqx01,sol2); |
i.e. a 20 ÂşC, 500 kPa y 50% en peso de propano (57% molar), la fracciĂłn molar de lĂquido es del 68% (con 47% de P y 53% de B), y la de gas es del 32% (con 78% de P y 22% de B).
NĂłtese que los valores dentro de cada fase coinciden con los determinados en el punto anterior.
Con los datos del NIST da 71% molar de lĂquido (con 49% de P y 51% de B), y 29% molar de gas (con 77% de P y 23% de B).
d) Masa interior en el caso anterior
Una primera aproximaciĂłn, sabiendo que la cantidad de sustancia en fase vapor no es despreciable, es suponer que Ă©sta ocupa casi todo el volumen (pues la misma cantidad de lĂquido ocuparĂa unas mil veces menos), con lo cual podemos estimar la cantidad de sustancia en fase gaseosa.
| > | nVapp:=p1*V/(R[u]*T1);nVapp_:=subs(T1=T0,Const,dat,dat1,%);eqnLapp:=xv0='nVapp/(nVapp+nLapp)';nLapp_:=nVapp_*subs(sol2_,1/xv0-1);MmL_:=subs(M1=M,g1dat,M2=M,g2dat,sol1_,xl1*M1+xl2*M2);MmV_:=subs(M1=M,g1dat,M2=M,g2dat,sol1_,xv1*M1+xv2*M2);mVapp_:=nVapp_*MmV_;mLapp_:=nLapp_*MmL_;mTapp_:=mVapp_+mLapp_; |
Si lo hacemos exactamente, con las composiciones conocidas, calculamos las masas molares (MmL y MmV), las densidades (rhoL y rhoV), las masa en funciĂłn del volumen lĂquido VL (mL y mV), las cantidades de sustancia correspondientes (nL y nV), y finalmente determinamos VL obligando a que nV/(nL+nV)=xv0.
| > | eqv:=v=x1*v1+x2*v2;eqrhoL:=MmL/rhoL=xl1*M1/rho1+xl2*M2/rho2;eqrhoV:=MmV/rhoV=xv1*R[u]*T0/p1+xv2*R[u]*T0/p1;rhoL_:=subs(M1=subs(dat1,M),M2=subs(dat2,M),rho1=subs(dat1,rho),rho2=subs(dat2,rho),MmL=MmL_,sol1_,solve(eqrhoL,rhoL));rhoV_:=subs(dat1,subs(MmV=MmV_,sol1_,Const,dat,solve(eqrhoV,rhoV)));nL:=rhoL*VL/MmL;nV:=rhoV*(V-VL)/MmV;eq:='nL/(nL+nV)'=xl0;eq_:=subs(dat,rhoL_*VL/MmL_/(rhoL_*VL/MmL_+rhoV_*(V-VL)/MmV_)=subs(sol2_,xl0));VL_:=solve(%,VL);'VL_'=VL_*1e6*cm3_/m_^3;mL_:=rhoL_*VL_;mV_:=subs(dat,rhoV_*(V-VL_));mT_:=mL_+mV_; |
i.e. hay 0,37 litros de lĂquido (y 9,63 L de gas). La masa total es de 0,31 kg (0,22 kg de L y 0,09 kg de V). Con los datos del NIST da mT=0,38 kg (rhoT=38,5 kg/m3, rhoL=545 kg/m3 y rhoV=10,9 kg/m3).
| > |
| > |
ADICIONAL
En el lĂmite de lĂquido saturado, la densidad serĂa la de una mezcla lĂquida con esa composiciĂłn (xP=0,47; xB=0,53), y en el lĂmite de vapor saturado la densidad serĂa la de una mezcla gaseosa con esa composiciĂłn (xP=0,78; xB=0,22).
| > | eqrhoL:=V/(mL/MmL)=x1*M1/rho1+x2*M2/rho2;x1_:=x1boil_;x1__:=x1_:x2_:=1-x1_;MmL_:=subs(M1=M,g1dat,M2=M,g2dat,x1_*M1+x2_*M2);mL_:=subs(MmL=MmL_,M1=M,rho1=rho,g1dat,l1dat,M2=M,rho2=rho,g2dat,l2dat,x1=x1_,x2=x2_,dat,solve(eqrhoL,mL));eqrhoV:=V/(mV/MmV)=x1*R[u]*T0/p1+x2*R[u]*T0/p1;x1_:=x1dew_;x2_:=1-x1_;MmV_:=subs(M1=M,g1dat,M2=M,g2dat,x1_*M1+x2_*M2);mV_:=subs(MmV=MmV_,Const,x1=x1_,x2=x2_,dat,SI2,solve(eqrhoV,mV)); |
Si todo fuera lĂquido (xP<0,47):
| > | n:=3:for i from 0 to n do x1||i:=x1__*i/n;x2_:=1-%;MmL_:=subs(M1=M,g1dat,M2=M,g2dat,x1||i*M1+x2_*M2);mL||i:=subs(MmL=MmL_,M1=M,rho1=rho,g1dat,l1dat,M2=M,rho2=rho,g2dat,l2dat,x1=x1||i,x2=x2_,dat,solve(eqrhoL,mL));print(`ì=`,i,` x1=`,x1||i,` mL=`,mL||i);od:pl1:=plot(subs(SI0,[seq([x1||i,mL||i],i=0..n)]),xP=0..1,mT_kg=0..6): |
Si todo fuera vapor (xP>0,78):
| > | n:=3:for i from 0 to n do x1||i:=x1_+(1-x1_)*i/n;x2_:=1-%;MmV_:=subs(M1=M,g1dat,M2=M,g2dat,x1||i*M1+x2_*M2);mV||i:=subs(MmV=MmV_,Const,x1=x1||i,x2=x2_,dat,SI2,solve(eqrhoV,mV));print(`ì=`,i,` x1=`,x1||i,` mV=`,mV||i);od:pl2:=plot(subs(SI0,[seq([x1||i,mV||i],i=0..n)]),xP=0..1): |
Si hay lĂquido y vapor, llamando phi a la fracciĂłn molar global de vapor (phi=xv0):
| > | n:=9:for i from 0 to n do x1||i:=x1__+(x1_-x1__)*(i/n)^2; x2_:=1-%;sol2_:=subs(x01=x1||i,x02=1-x1||i,dat,sol1_,sol2);MmL_:=subs(M1=M,g1dat,M2=M,g2dat,x1||i*M1+x2_*M2);rhoL_:=subs(rho1=rho,l1dat,rho2=rho,l2dat,x1||i*rho1+x2_*rho2);phi||i:=subs(sol2_,MmL=MmL_,rhoL=rhoL_,Const,dat,SI2,1/(p1*xl0*MmL/(R[u]*T0*xv0*rhoL)+1));mL:=subs(dat,rhoL_*(1-phi||i)*V);mV:=subs(Const,dat,SI2,phi||i*V*p1*MmV_/(R[u]*T0));m||i:=mL+mV;print(`ì=`,i,` x1=`,x1||i,` phi=`,phi||i,` mT=`,m||i); od:pl3:=plot(subs(SI0,[seq([x1||i,m||i],i=0..n)]),xP=0..1):pl4:=plot(subs(SI0,[[x1__,0],[x1__,mL_],[x1_,mV_],[x1_,0]]),xP=0..1,linestyle=dash):with(plots):display([pl1,pl2,pl3,pl4]); |
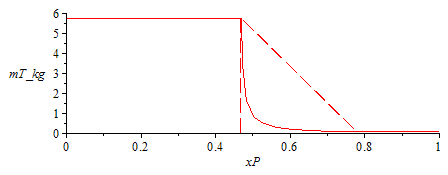 |
ObsĂ©rvese quĂ© deprisa cae el masa interior con la fracciĂłn molar global (se ha dibujado a trazos la interpolaciĂłn lineal). La explicaciĂłn es que, como la diferencia de densidades entre la fase lĂquida y la vapor es tan grande, a poco que se incremente el porcentaje en masa o molar de vapor, esto requiere volĂşmenes de vapor muy grandes.
| > |