| > | restart:#"m06_p53" |
Se desea evaluar la posibilidad de utilizar nitrógeno líquido a presión ambiente como 'combustible' de un coche, que funcionaría con un motor térmico intercambiando calor con el nitrógeno y la atmósfera. Se pide
a) Temperatura, densidad, energía interna, entalpía y entropía del nitrógeno en los estados termodinámicos de interés.
b) Trabajo máximo obtenible por unidad de masa, y su comparación con el de un motor de gasolina de poder calorífico 47 MJ/kg y rendimiento energético del 25%.
c) Esquema de bloques de principio de un motor de Carnot que funcionase entre las temperaturas extremas, y su rendimiento.
d) Comparar el trabajo máximo obtenible del nitrógeno líquido con el del motor de Carnot.
Datos:
| > | read"../therm_eq.m":read"../therm_proc.m":with(therm_proc): |
| > | su1:="N2":dat:=[PC=47e6*J_/kg_,eta[G]=0.25]: |

Esquema:
| > |
| > |
Eqs. const.:
| > | gdat:=get_gas_data(su1):ldat:=get_liq_data(su1):dat:=op(dat),gdat,ldat,Const,SI2,SI1:get_pv_data(su1): |
a) Temperatura, densidad, energía interna, entalpía y entropía del nitrógeno en los estados termodinámicos de interés.
Estado 1: Tb,p0; estado 0: T0,p0.
| > | T1:=T[b];'T1'=subs(dat,T1);rho1:=rho[L];rho1:=subs(dat,rho);eqrho:=rho0=p0/(R*T0);eqrho_:=subs(dat,eqrho):evalf(%,2);h10:=-c[p]*(T0-T1)-h[lv0];h10_:=subs(dat,h10):'h10'=evalf(%,2);u10:='h10+p0*v0-p1*v1';u10:='h10-p0*v10';u10:='h10+p0*(1/rho0-1/rho1)';u10_:=subs(eqrho_,dat,u10):'u10'=evalf(%,2);s10:=-c[p]*ln(T0/T1)-h[lv0]/T[b];s10_:=subs(dat,evalf(subs(dat,s10))):'s10'=evalf(%,2); |
b) Trabajo máximo obtenible por unidad de masa, y su comparación con el de un motor de gasolina de poder calorífico 47 MJ/kg y rendimiento energético del 25%.
Por unidad de masa, como volumen de control en régimen estacionario, la exergía es:
| > | phi10:='h10-T0*s10';phi10_:=subs(dat,evalf(subs(dat,phi10))):'phi10'=evalf(%,2);w[G]:=PC*eta[G];w[G]:=evalf(subs(dat,%),2); |
i.e. el nitrógeno líquido (LN2) puede recibir 420 kJ/kg de calor (al atemperarse), y podría proporcionar hasta 720 kJ/kg de trabajo (límite termodinámico). La gasolina podría dar 47000 kJ/kg de calor al arder con aire, y suministra 1200 kJ/kg de trabajo, luego, energéticamente es más rentable la gasolina, y eso que comparamos lo que 'da' la gasolina con lo 'máximo que podría dar' el LN2 (pero en las soluciones ingenieriles influyen además los aspectos económicos, ambientales, políticos, etc.).
Como era previsible, el nitrógeno líquido tienes menos entalpía pero más exergía que en condiciones ambiente (su 'poder calorífico' sería negativo: 'poder frigorífico', pero los motores térmicos funcionan tanto con calor como con frío). Además, por ser todo a presión ambiente, la exergía como masa de control dará el mismo valor.
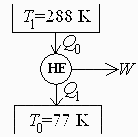
c) Esquema de bloques de principio de un motor de Carnot que funcionase entre las temperaturas extremas, y su rendimiento.
| > | eqCarnot:=eta='1-T1/T0';eqCarnot_:=subs(dat,eqCarnot):evalf(%,2); |
d) Comparar el trabajo máximo obtenible del nitrógeno líquido con el del motor de Carnot.
Con ese motor térmico de Carnot sólo se podría aprovechar el calor durante el cambio de fase, que al ser a presión constante es la hlv, luego:
| > | eqW:=eta=W/Q0;eqQ0:=Q0=Q1+W;eqQ1:=Q1=h[lv0];eqW_:=subs(eqCarnot,eqQ0,eqQ1,eqW):W_:=subs(dat,solve(eqW_,W)):'W'=evalf(%,2); |
| > |
i.e., de los 720 kJ/kg de trabajo límite, una sóla máquina de Carnot ya daría 540 kJ/kg.